外泌体最先于 1983 年被 R M Johnstone 等人在体外培养的绵羊网织红细胞上清液中发现[1] 。然而,当时学术界认为外泌体只是红细胞的 “代谢废物”。因此,在很长一段时间里,外泌体始终都是一个籍籍无名的 “细胞垃圾”。
直至 2013 年,James E. Rothman、Randy W. Schekman 以及 Thomas C. Südhof 三位科学家发现细胞囊泡 (外泌体等) 运输调控机制,荣获诺贝尔生理/医学奖,让世界重新认识到外泌体这个自由穿梭于细胞间的运货小能手~
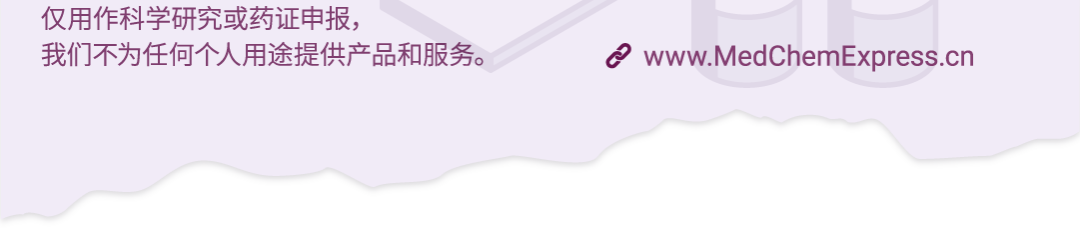
言归正传!外泌体 (Exosome) 是一种由细胞分泌到细胞外的囊泡 (图 1),直径为 40-150 nm,几乎能从所有细胞 (无论是原核细胞还是真核细胞) 中释放,广泛存在于各种生物体液 (血液、尿液、精液、唾液、母乳、脑脊液以及胆汁等) 中。

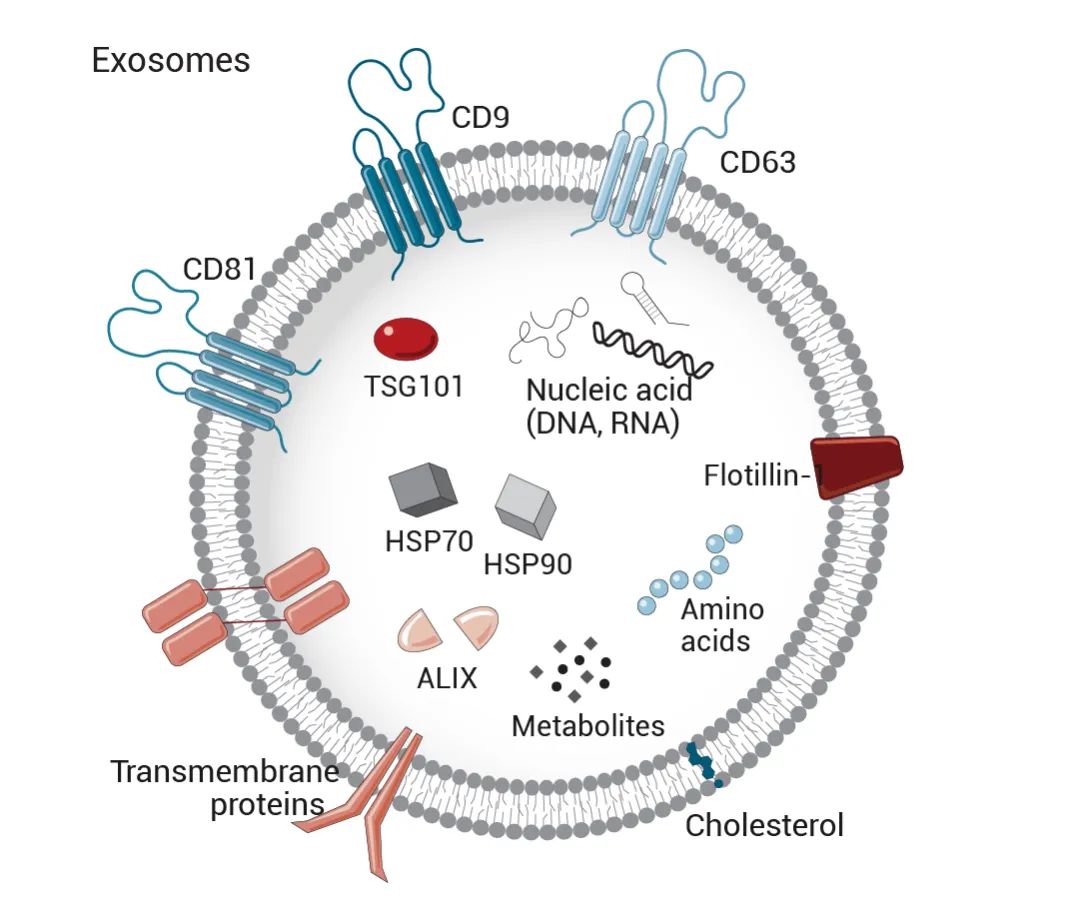
图 1. 外泌体的结构及功能[2]。
外泌体装载着各种细胞成分 (包括蛋白质、脂类、核酸、糖类、细胞器等),频繁穿梭于细胞间,将货物分子运送到正确目的地,实现细胞间信号传递。并且,外泌体大小不一,成分各异,能发挥不同的生物活性。
初次接触外泌体的小伙伴们是不是很难捋清外泌体与各种囊泡的关系?是否被各种五花八门的囊泡缩写搞得头疼?为方便各位更好进食本文,小 M 整理出一份外泌体相关囊泡的区分清单 (表 1),请保存使用哦~


目前,主流观点认为外泌体的产生过程为:细胞膜内陷形成内体,内体通过二次内陷形成细胞内多泡体 (MVBs),最后 MVBs 与细胞质膜融合,以胞吐的方式将 MVBs 的腔内囊泡 (ILVs) 分泌到细胞外,成为外泌体 (图 2)。
▐ 外泌体的生物发生
1) ESE 与 LSE 形成
细胞外成分,如蛋白质、脂类、代谢物、小分子和离子 (图 2),可通过内吞和质膜内陷与细胞表面蛋白质一起进入细胞,并在细胞腔侧出芽形成早期分选内体 (ESE),或使萌芽与由内质网、反式高尔基体网络 (TGN) 和线粒体等成分形成的 ESE 融合 (ESE 也可与 ER 和 TGN 融合)。ESE 又可进一步形成晚期分选内体 (LSE)。
2) ILVs 与 MVBs 形成
LSE 充盈着各种内含物 (蛋白质、核酸、脂类等),所以,当 LSE 膜内陷时,混合、随机地包裹内含物,形成多个腔内囊泡 (ILVs)。也就是说,根据内陷量,该过程会产生具有不同内含物和不同大小的 ILVs。LSE 膜内陷剩余的膜作为外膜,使形成的 ILVs 集中在 LSE 腔内,也即,LSE 进一步形成了细胞内多泡体 (MVBs)。简单来说,ILVs 是在 MVBs 中形成的。
3) 外泌体形成
MVBs 可与自噬体融合,最终其内容物可在溶酶体中降解 (MVBs 也可以直接与溶酶体融合进行降解),降解产物可被细胞回收利用。此外,MVBs 也可通过细胞骨架和微管网络运输到质膜,并在 MVBs 对接蛋白的帮助下与质膜融合,通过胞吐作用,将 MVBs 的 ILVs 分泌到细胞外成为外泌体。

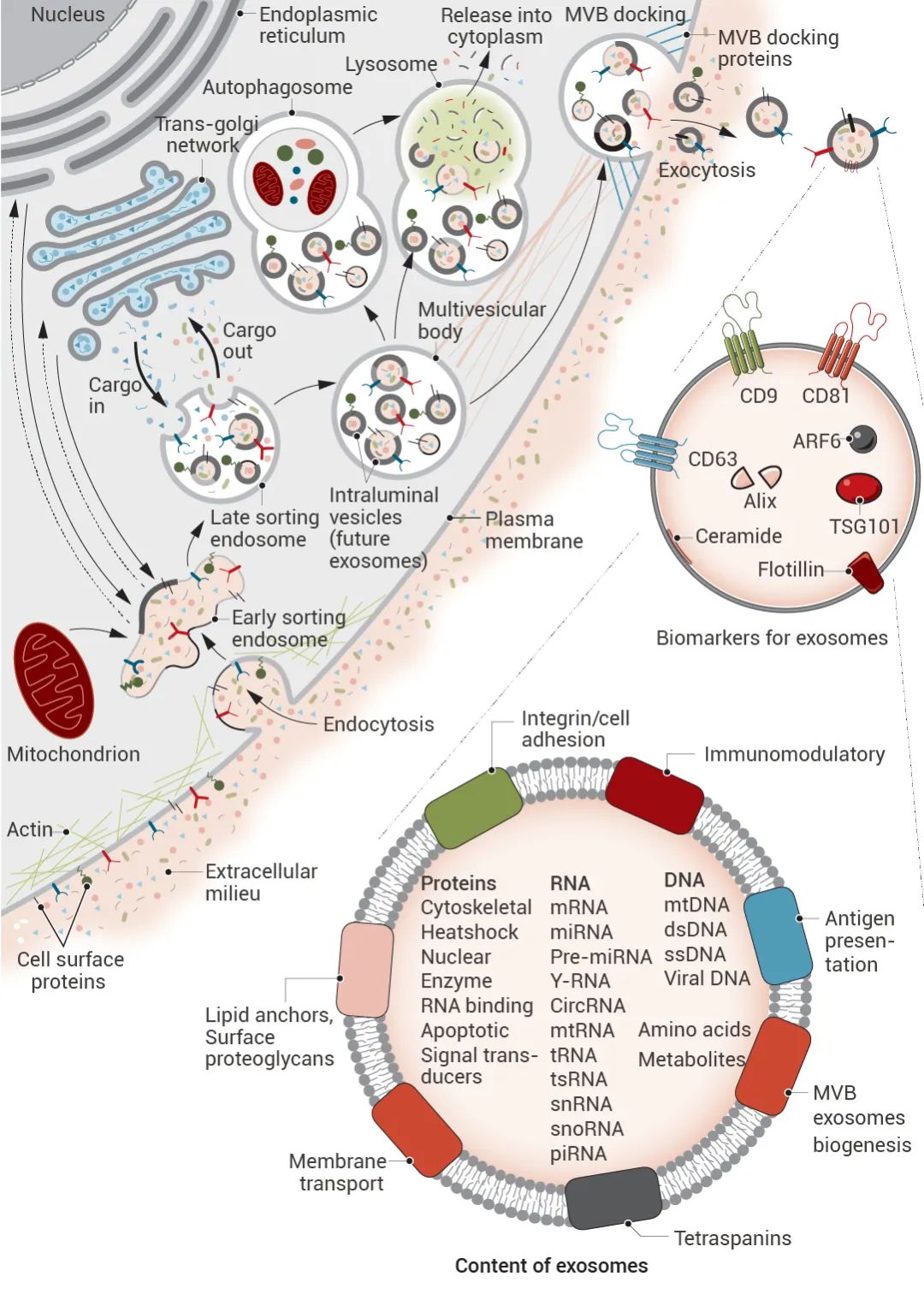
图 2. 外泌体的内含物和生物发生[2]。
▐ 外泌体具有异质性
前面说到,LSE 通过膜内陷产生内含物各异的 ILVs,ILVs 被 MVBs 分泌到细胞外从而成为外泌体。然而,MVBs 外膜内陷不均匀,会使外泌体内含物不一致。并且,MVBs 也可与其他 ILVs 和细胞器融合,从而导致外泌体成分的多样性。此外,根据来源细胞的不同,外泌体的内含物也会产生差异。简单来说,外泌体具有异质性。

图 3. 外泌体异质性[2]。
外泌体的异质性可根据其大小、内容物、对受体细胞的功能性影响以及来源细胞来进行概念化 (图 3)。这些特征的不同组合所形成的外泌体在生物体内会展示出不同的生物活性。

目前,外泌体在疾病诊断、治疗以及药物递送三个方面,都展现出较好的研究潜力 (图 4)。

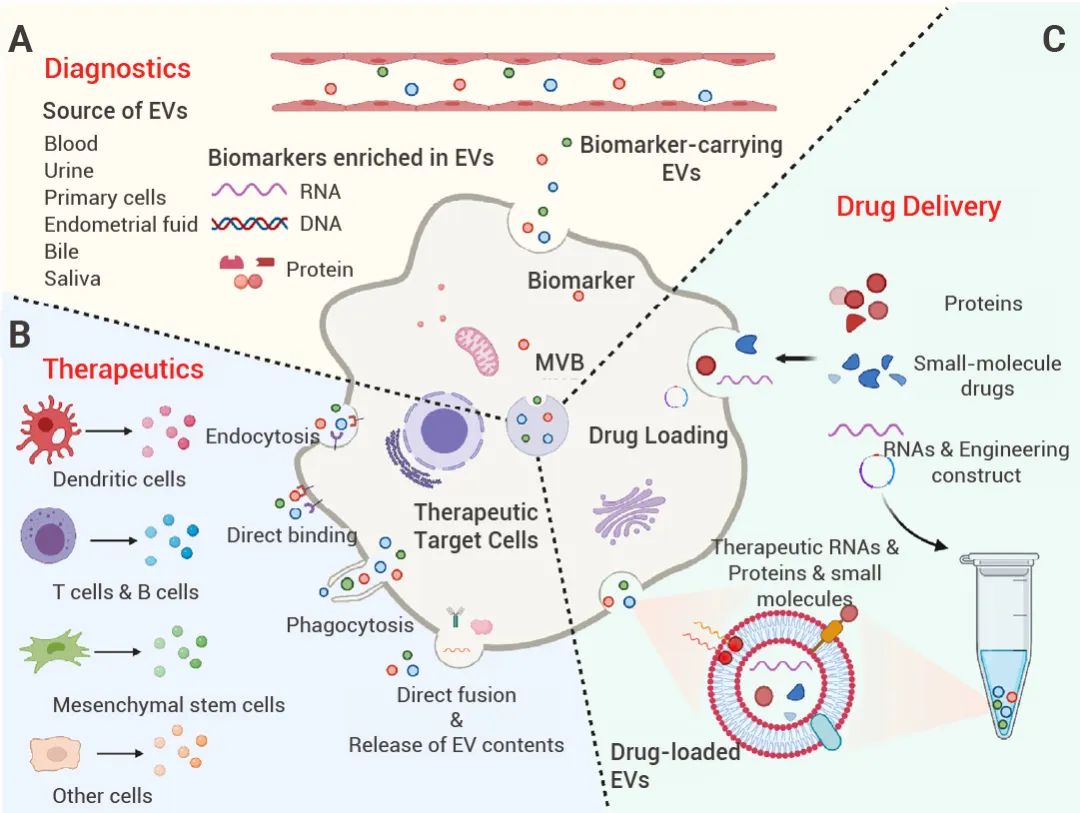
图 4. 外泌体的三个主要研究方向[6]。
▐ 外泌体:疾病诊断标志物
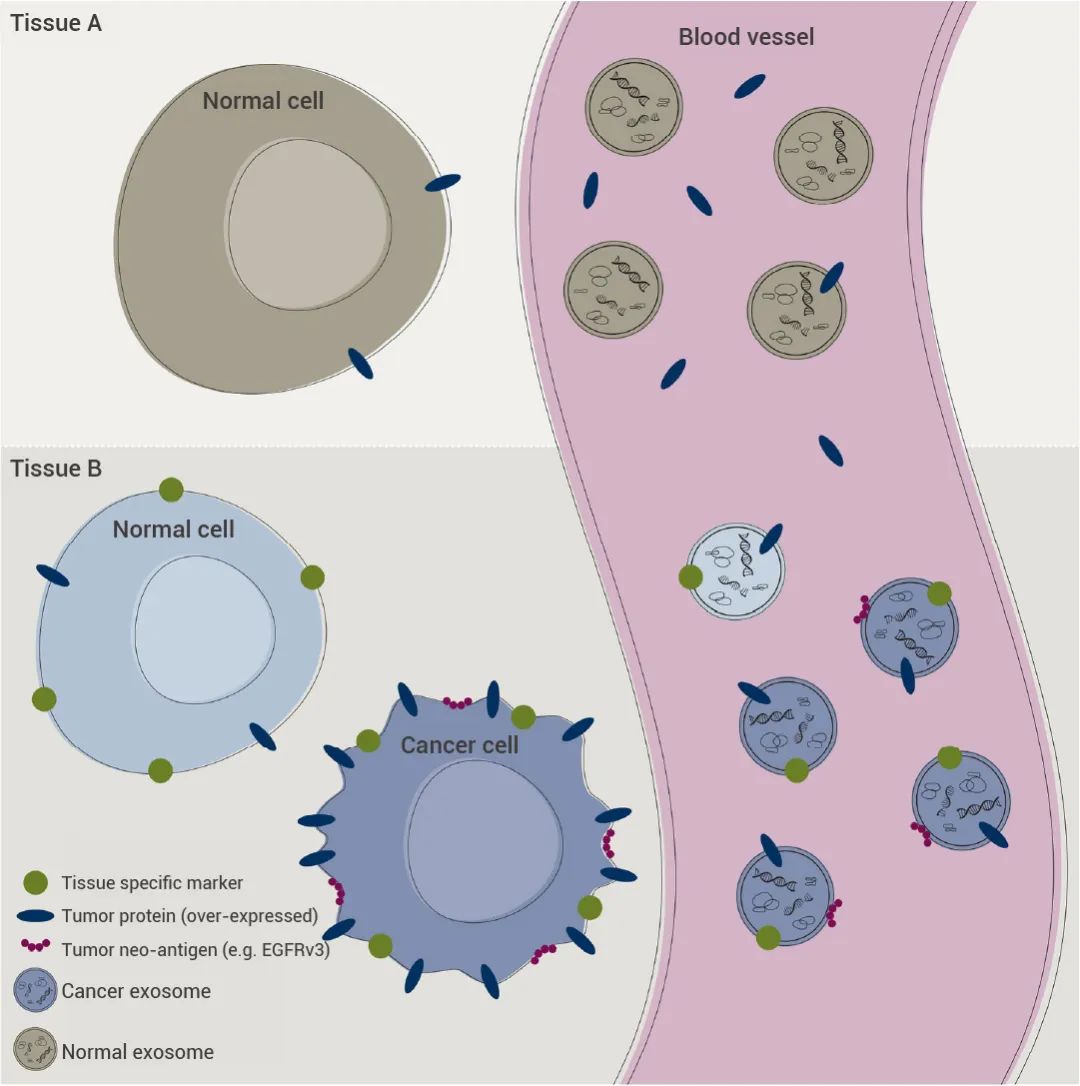
外泌体是细胞 (包括癌细胞) 释放到周围生物流体中的小囊泡。这些外泌体含有源自肿瘤的物质,如 DNA、RNA、蛋白质、脂质、糖结构和代谢物。因此,在病理微环境下产生的外泌体能够捕获特定疾病阶段或损伤所特有的复杂细胞内分子特征,是一个极具潜力的生物标志物库。
重要的是,从血液或其他生物流体中分离出的肿瘤中过度表达的蛋白质并不一定具有癌症特异性。非癌症组织也能产生相同的标志物,并在正常人体内产生不同数量的标志物。而通过用组织特异性 (或癌症特异性) 标志物富集外泌体,可以获得更高的灵敏度和/或特异性。
外泌体作为疾病诊断标志物的优势:
1) 广泛存在于各种生物流体中,并非常稳定;
2) 可在疾病早期阶段进行诊断 (外泌体在肿瘤形成的各个阶段从细胞中主动释放出来);
3) 可实现癌症特异性标志物的富集 (图 5);
4) (液体活检相较于组织活检) 创伤小、成本低、可实时了解肿瘤状态;
5) 相较于组织活检,可减少患者取样痛苦;
6) 易储存:冷冻、冷冻干燥或喷雾干燥。
相较于传统的组织活检,基于外泌体的液体活检具有更高的应用价值。目前,首个基于外泌体 RNA 的前列腺癌检测方法也已问世[7]。

▐ 外泌体:良好的疾病治疗潜力
从多种细胞中提取的外泌体可通过各种途径与靶细胞相互作用,包括内吞、直接结合、吞噬和直接融合,从而产生特定的治疗效果。比如,Jeongyeon Heo 等人研究发现,外泌体在不同细胞类型 (包括内皮细胞、血管平滑肌细胞和巨噬细胞) 之间进行物质交换可改善动脉粥样硬化[9]。
此外,外泌体在癌症、神经退行性疾病、代谢性疾病以及免疫与炎症等疾病中也具有生物活性。
▐ 外泌体:天然的药物递送载体
外泌体可被修饰以靶向特定细胞,能负载多种类的药物,并具有优越的穿透各种组织屏障的能力 (比如血脑屏障),是优良的天然药物递送载体。
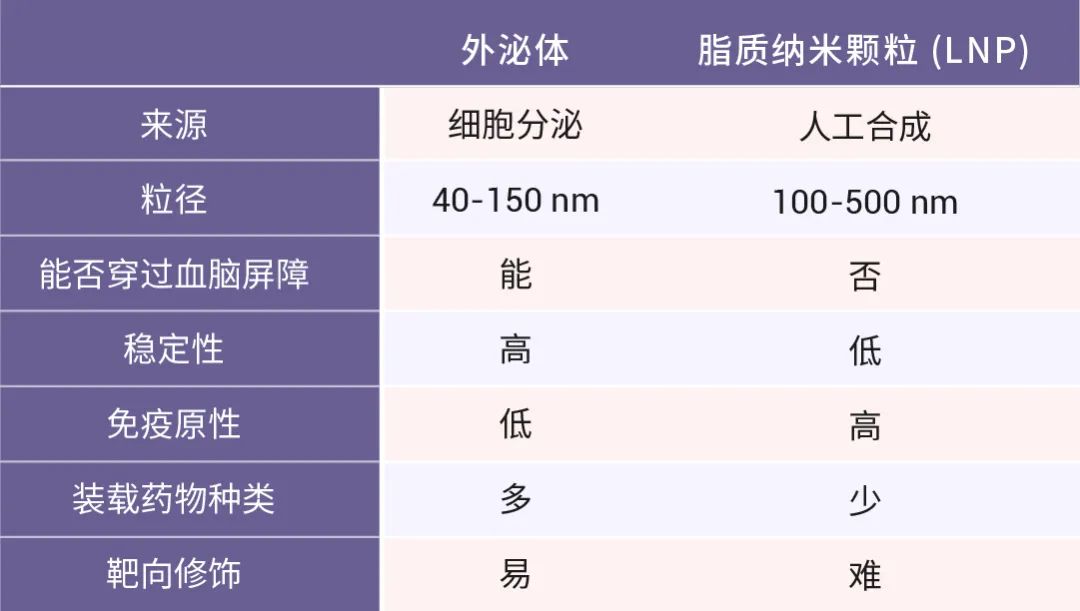
相较而言,外泌体表现出比脂质纳米颗粒 (LNP) 更低的免疫原性,毒性也显著降低 (表 2)。外泌体也表现出更好的药物封装、控释以及体内生物分布能力。此外,外泌体在肿瘤细胞内的粘附性和内化性比同等大小的脂质体高 10 倍,这说明,外泌体对癌症的靶向性更高。
外泌体作为药物递送载体的潜力已被大量研究证实。Menghui Zhang 等人的临床前研究显示,工程外泌体能够高效、精确地将抗肿瘤药物递送到小鼠肿瘤部位,并减少了与治疗相关的不良反应 (图 6)[11]。

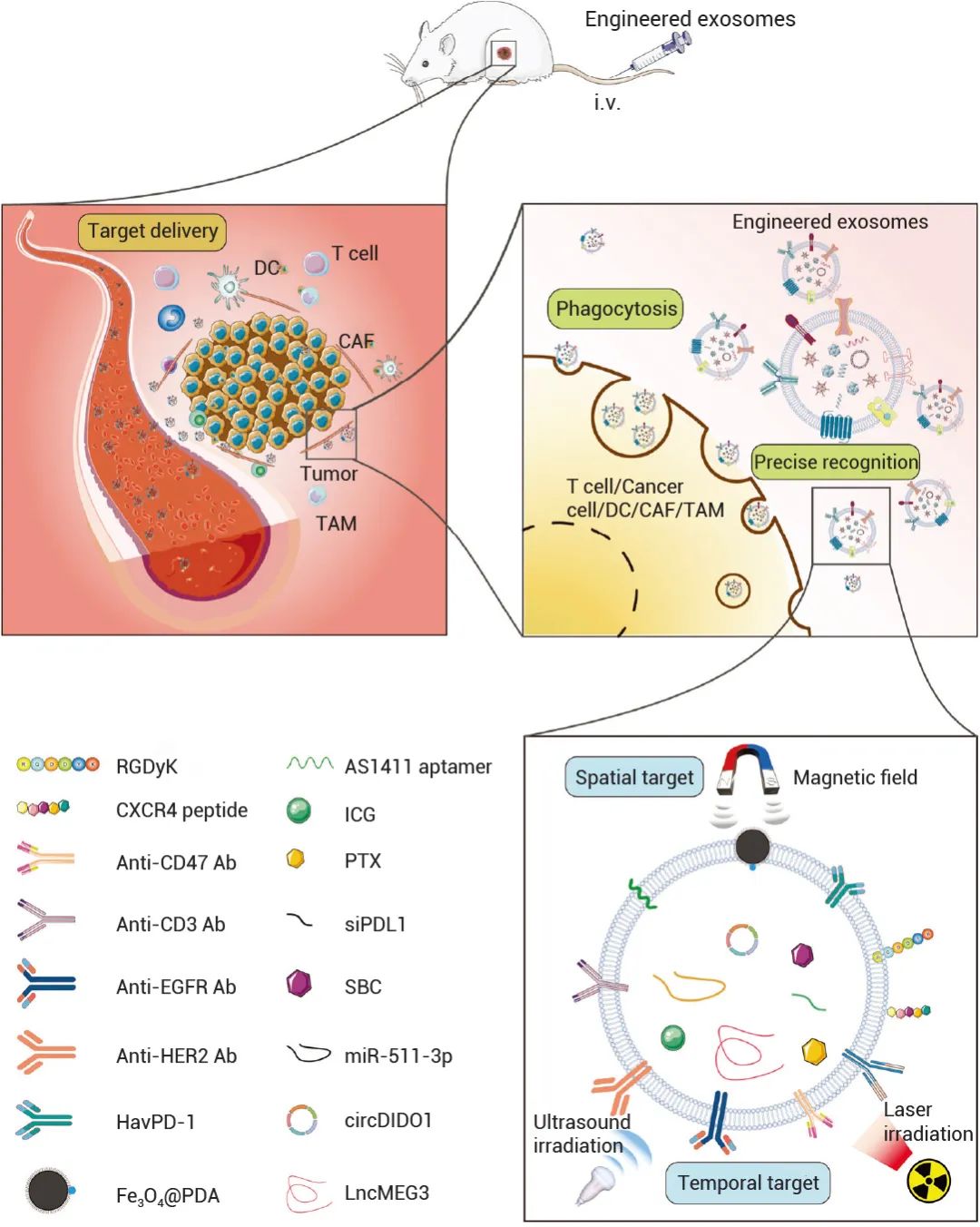
图 6. 临床前模型中显示抗肿瘤效果的工程外泌体示意图[11]。
如图 6 所示,静脉注射后,携带药物分子的工程外泌体在多种靶向分子的引导下到达肿瘤部位。然后,化疗药物 (如 PTX)、ncRNA (如 miR-551-3p)、免疫分子 (如 siPDL1) 被释放到肿瘤微环境 (TME) 中。最终,工程外泌体的内化导致肿瘤细胞死亡。
本期推文为大家详细介绍了外泌体的特点、生物发生过程以及三大研究方向:疾病的诊断、治疗以及药物递送。外泌体研究领域极其广泛,在癌症、免疫反应、心血管疾病、中枢神经系统疾病等领域都有深入的研究。掌握外泌体的研究方法,会让我们发现外泌体的更多可能!

|
收录了 40+ 种具有激活或抑制外泌体分泌的化合物,是外泌体研究的有用工具。 |
|
非竞争性的中性鞘磷脂酶 (N-SMase) 抑制剂,IC50 值为 1 μM;是外泌体合成/释放的抑制剂。 |
|
质子泵抑制剂,能抑制胃酸生成;是中性鞘磷脂酶 (N-SMase) 的抑制剂 (外泌体抑制剂)。 |
|
Exosome Isolation and Purification Kit (from cell culture media) 细胞上清外泌体提取纯化试剂盒。 |
| MOG (35-55) (TFA)Exosome Isolation and Purification Kit (from plasma and serum)
Tipifarnib (IND 58359) 抑制法尼基转移酶 (FTase),IC50 为 0.86 nM。Tipifarnib 具有潜在抗肿瘤和抗寄生虫活性。 |
|
法尼基转移酶 (FTase) 抑制剂,IC50 为 0.86 nM;具有潜在抗肿瘤活性;是外泌体 (exosome) 生成和/或分泌的有效抑制剂。 有效的碳酸酐酶 (CA) 抑制剂;有效的外泌体 (exosome) 抑制剂,IC50 为 0.2 μM。 |


[1] Pan BT, et al. Fate of the transferrin receptor during maturation of sheep reticulocytes in vitro: selective externalization of the receptor. Cell. 1983 Jul;33(3):967-78.
[2] Kalluri R, et al. The biology, function, and biomedical applications of exosomes. Science. 2020 Feb 7;367(6478):eaau6977.
[3] EL Andaloussi S, et al Extracellular vesicles: biology and emerging therapeutic opportunities. Nat Rev Drug Discov. 2013 May;12(5):347-57.
[4] Cocozza F, et al. SnapShot: Extracellular Vesicles. Cell. 2020 Jul 9;182(1):262-262.e1.
[5] Chen B, et al. Endocytic sorting and recycling require membrane phosphatidylserine asymmetry maintained by TAT-1/CHAT-1. PLoS Genet. 2010 Dec 9;6(12):e1001235.
[6] Escudé Martinez de Castilla P, et al. Extracellular vesicles as a drug delivery system: A systematic review of preclinical studies. Adv Drug Deliv Rev. 2021 Aug;175:113801.