一. Nature Communications︱细菌联合治疗慢性免疫介导性结肠炎与恢复肠道内稳态

炎症性肠病(IBD)包括两种主要的临床疾病:克罗恩病和溃疡性结肠炎。慢性肠道炎症可由多种外源性和内源性信号所诱导发生。目前的IBD治疗策略主要为抗炎和免疫抑制疗法,这些药物仅在一小部分患者中能够诱导持续的、无类固醇的缓解,且可能具有多种严重的副作用。此外,这些药物并不能纠正包括渗漏的粘膜屏障、促炎肠道微生物组和免疫调节缺陷这些引起慢性炎症的相关机制。活生物治疗药物用于治疗IBD是一种可行的替代疗法,早期发现梭状芽孢杆菌IV和XIVa可以减轻动物模型中的IBD炎症反应。因此本文通过代谢相互依存关系合理设计出具有高定植力菌株组合,并将其用于治疗实验性结肠炎。
(1) GUT-103菌群的设计。作者首先从健康人粪便样本中分离菌株可以组合成一个代谢相互依赖的菌群,对菌群中的基因组注释出可能编码所需治疗IBD的蛋白质,鉴定出保守的属。通过菌株彼此之间互补必需氨基酸、维生素和辅因子等关系,选出17株菌组成GUT-103,它们之间代谢依赖的治疗功能。与其他不能在肠道中生存并快速通过系统的益生菌相比,这些组合使细菌在结肠中停留更长时间;
(2)GUT-103成功预防和治疗实验性结肠炎。作者通过实验模型模拟GUT-103在IBD炎症环境中协同保护肠道稳态和定殖,发现这些优势菌群可合成SCFA和吲哚,预防和治疗慢性免疫介导的结肠炎,并分析了代谢物质组的平衡、不同菌株营养缺陷反应和相互作用。发现GUT-103可以定殖肠道,不会引起炎症反应,代谢组学分析其有效降低了结合胆汁酸的水平,尤其是牛磺酸结合胆汁酸。总之,这些结果证明了GUT-103的保护和治疗活性,并在体内验证了这种合理设计的联合体预期的病理生物替代物和保护性代谢功能;
(3) 优化GUT-108菌株组合的设计及其在人源化小鼠中的应用。接着根据GUT-103的数据优化17株菌为11株,组成GUT-108,在人源化慢性T细胞介导的小鼠模型中可以逆转结肠炎;
(4)GUT-108逆转肠道菌群失调,恢复肠上皮功能。它可以减少肺炎克雷伯菌、肠沙门氏菌、大肠杆菌和志贺氏菌等病原体,同时扩大定殖的保护菌和有益菌;产生促进粘膜愈合和免疫调节反应的代谢物,如短链脂肪酸、吲哚类和有益胆汁酸;减少炎性细胞因子和Th-1和Th-17细胞;诱导产生IL-10的结肠调节细胞,以及IL-10非依赖的稳态通路。因此,作者建议GUT-108用于治疗和预防IBD和其他以微生物区系和粘膜通透性失衡为特征的炎症情况的复发。
Rationally designed bacterial consortia to treat chronic immune-mediated colitis and restore intestinal homeostasis. Nature Communications. 2021. https://doi.org/10.1038/s41467-021-23460-x.
原文阅读,请长按识别下方二维码

二. Nature Microbiology︱高脂饮食喂养的小鼠肠道微生物组的改变与抗生素耐受性相关

抗生素耐受性是一种典型的易感微生物在长期暴露于抗生素下生存的能力,在慢性和复发性细菌感染中起着关键作用,并促进抗生素耐药性的演变。然而促进抗生素耐受性发展的生理因素,特别是在体内,尚不完全清楚。高脂饮食(HFD)已有研究报道了与多种人类疾病有关,包括肥胖、糖尿病、肿瘤、大脑胰岛素抵抗、认知缺陷以及肠道微生态失衡等,高脂饮食通过胃肠道产生生理作用,并与肠道菌群有着重要的关联,但HFD和抗生素功效之间的关系仍然知之甚少。本文通过对它们之间的联系,发现HFD对小鼠模型中的抗生素治疗有拮抗作用,并证明这与肠道微生物群和IAA产生的改变有关。
(1)动物实验设计:研究人员采用8周雌性CD-1小鼠,分别进行标准喂食和高脂饮食喂养,通过红油O染色、血清生化参数分析、标准饮食小鼠环丙沙星抗生素有效性分析、药代动力学分析、小鼠肠道微生物消除后进行抗生素有效性分析、粪便菌群移植、肠道菌群分析、代谢组学分析,评估了临床相关杀菌抗生素对HFD模式喂养的感染耐甲氧西林金黄色葡萄球菌(MRSA)或大肠杆菌的小鼠的有效性;
(2)HFD影响杀菌抗生素的疗效和对小鼠肠道菌群组成的影响。研究人员发现,与标准喂养的小鼠相比,高脂饮食的小鼠有更高的细菌负担,这些细菌对杀菌抗生素治疗表现出较低的易感性,且去除微生物的标准饮食小鼠与喂食高脂饲料的小鼠表现出类似的易感性。长期HFD喂养的小鼠确实降低了肠道微生物群的多样性,特别是对于某些共生细菌,如拟杆菌科和阿克曼氏菌科;
(3)HFD降低了IAA的含量。利用UPLC-Q-Exactive Orbitrap mass spectrometer对动物粪便进行的代谢组学分析显示,HFD喂养改变了粪便代谢物组成,差异代谢产物主要集中在有机酸相关代谢,包括胆汁酸生物合成、α-亚麻酸和花生四烯酸代谢以及色氨酸代谢。值得注意的是,HFD喂养的小鼠色氨酸代谢物吲哚-3-乙suan(IAA)显著降低。进一步分析监测发现喂食HFD5周后小鼠体内的IAA浓度显著降低。喂食9周后,HFD喂养小鼠的血清和肺组织中的IAA含量也低于标准饮食喂养小鼠;
(4)IAA促进细菌代谢,防止抗生素抵抗。进一步的体外研究表明,补充IAA可能通过激活细菌代谢途径,抑制细菌持续细胞的形成,并与抗生素治疗联合能促进细菌持续细胞的消除。体内研究表明,IAA和环丙沙星联合使用提高了HDF喂养的MRSA持续感染的小鼠的存活率。
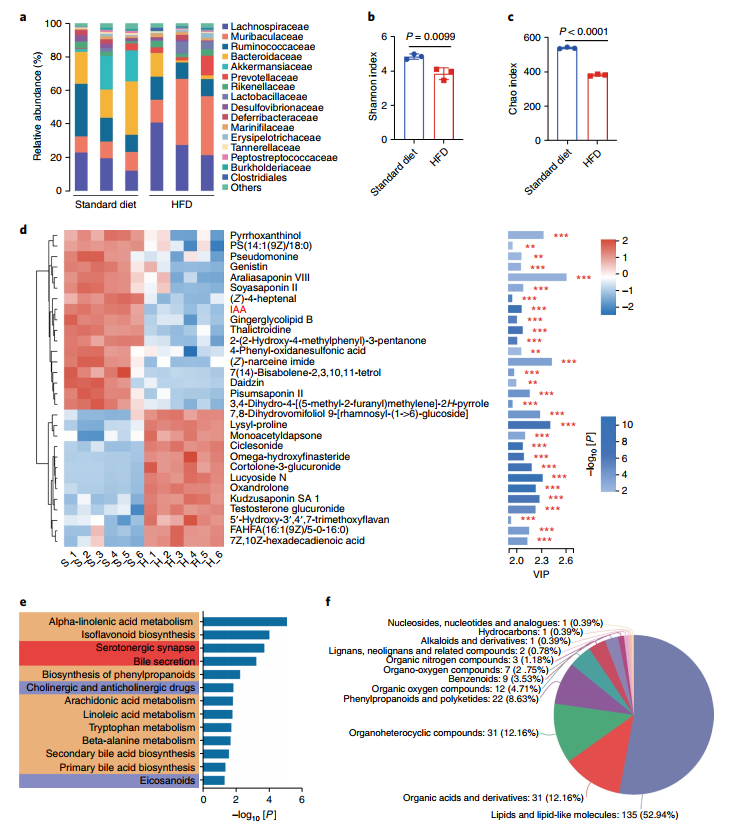
HFD喂养小鼠粪便微生物群和代谢组的变化
Gut microbiome alterations in high-fat-diet-fed mice are associated with antibiotic tolerance. Nature Microbiology. 2021. https://doi.org/10.1038/s41564-021-00912-0.
原文阅读,请长按识别下方二维码

三. Gut︱多组学系统分析色氨酸代谢与2型糖尿病的相关性

色氨酸可通过宿主的犬尿氨酸途径和微生物的吲哚途径,代谢为不同的代谢产物,对宿主生理功能产生重要影响。目前还没有研究检测宿主和微生物色氨酸代谢和T2D整合宿主全基因组变异、饮食摄入、肠道微生物组和宿主和微生物色氨酸代谢产物循环水平的数据。本研究对人体代谢健康的意义本研究通过对多种族的5个队列样本进行分析,鉴定出与2型糖尿病(T2D)相关的色氨酸代谢产物,并进一步揭示了与这些代谢物相关的宿主遗传、饮食和肠道微生物因素。
(1)纳入5个队列的9180人,基线时无糖尿病,随访后共2032人患2型糖尿病,代谢组学分析发现T2D风险与血液中色氨酸、4种犬尿氨酸代谢物和吲哚乳酸呈正相关,与吲哚丙suan呈负相关;
(2)全基因组荟萃分析(n=9290)在13个位点识别了21个独立信号,与11个色氨酸代谢物中的9个相关,吲哚丙suan与T2D有潜在的因果关系;与色氨酸代谢物最密切相关的饮食因素是高纤维食物,而非高蛋白/色氨酸食物;
(3)进一步分析纤维摄入、肠道菌群与血清吲哚衍生物的关联,吲哚丙suan相关肠道细菌(主要是利用纤维的厚壁菌门)部分介导了纤维-吲哚丙suan的关联,而双歧杆菌可能参与吲哚丙suan相关的其他途径;
(4)宿主乳糖酶LCT变异与血清吲哚丙suan存在关联,可能与宿主基因-饮食对双歧杆菌的相互作用有关,牛奶摄入与肠道双歧杆菌和血液吲哚丙suan的正相关性,仅存在于不持续表达乳糖酶的个体中。
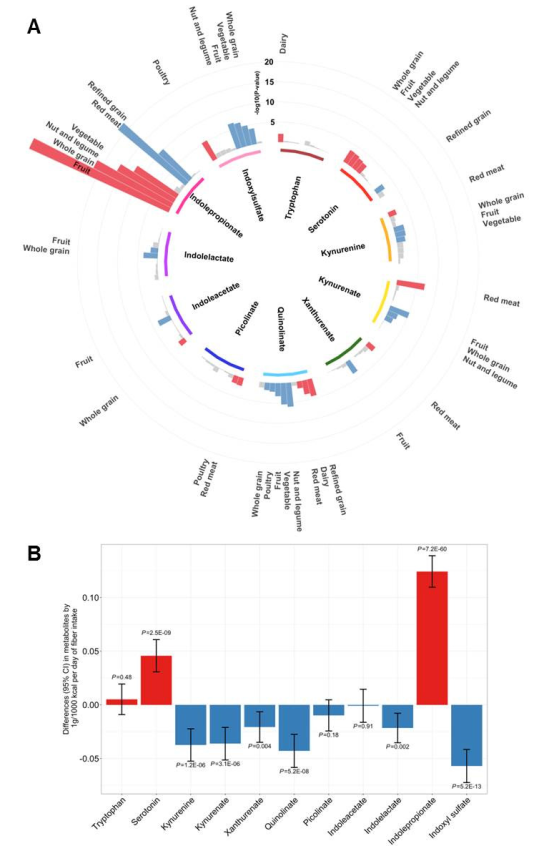
饮食摄入与血清色氨酸代谢物水平
Host and gut microbial tryptophan metabolism and type 2 diabetes: an integrative analysis of host genetics, diet, gut microbiome and circulating metabolites in cohort studies. Gut. 2021. https://doi.org/ 10.1136/gutjnl-2021-324053.
原文阅读,请长按识别下方二维码

四. PNAS︱丁suan通过增强CPT1A活性促进脂肪酸氧化和iTreg分化

诱导型调节T细胞(iTreg)在免疫抑制中起着关键作用。越来越多的证据表明iTreg分化与代谢重编程特别是脂肪酸氧化(FAO)之间存在密切联系。丁suan作为一种特殊的短链脂肪酸(SCFA)在维持肠道稳态中起着关键作用,其可通过上调组蛋白乙酰化来促进iTreg。本研究揭示了丁suan在iTreg分化中的一个以前未被重视的机制,即丁suan-BCoA(丁酰辅酶A)-CPT1A调节轴,调节免疫稳态。
(1)首先观察到丁suan的存在增强了组蛋白乙酰化并在体外上调了 iTreg 生成,丁suan可增强CPT1A依赖性的FAO,以促进iTreg分化,但其作为直接底物的作用似乎不能促进iTreg诱导的增加;
(2)探究FAO的调控以及丁suan对iTreg的分化是否是通过CPT1进行的,结果发现,只有丁suan显著提高了CPT1活性,并通过CPT1促进iTreg生成,进一步分析表明,CPT1的亚型CPT1A在丁suan诱导的iTreg分化中起关键作用;
(3)进一步研究丁suaniTreg分化过程中对CPT1A活性的调节,发现丁suan在细胞中可直接催化生成BCoA,BCoA通过与MCoA竞争性结合CPT1A,以拮抗MCoA对CPT1A的抑制作用,从而增强CPT1A的活性;
(4)酰基辅酶A合成酶短链家族成员2(ACSS2)可将丁suan转化为BCoA,是丁suan诱导iTreg分化所必需的;
(5)利用小鼠模型研究ACSS2-BCoA在结肠炎中的作用,结果发现丁suan显著减轻了小鼠结肠炎相关的病理改变,并增强了肠系膜淋巴结(MLN)和结肠固有层(cLP)中的Treg细胞频率,而ACSS2的抑制降低了这些小鼠中丁suan介导的效应。
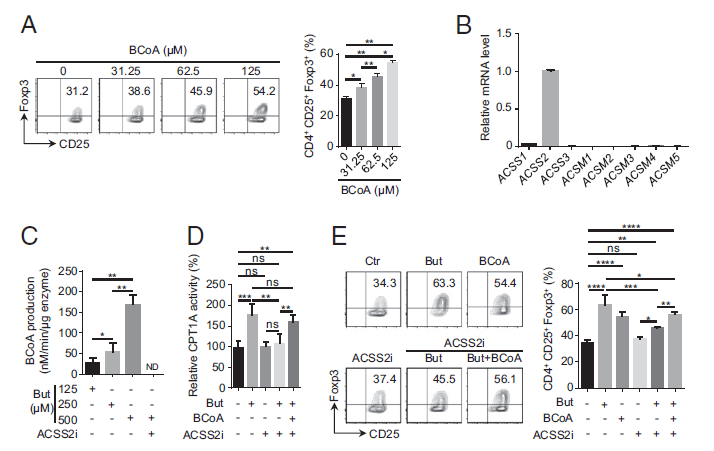
丁suan盐对iTreg细胞的诱导依赖于ACSS2生成丁酰辅酶A
Butyrate enhances CPT1A activity to promote fatty acid oxidation and iTreg differentiation. PNAS. 2021. https://doi.org/10.1073/pnas.2014681118.
原文阅读,请长按识别下方二维码

五. Cell Metabolism | 酸性肿瘤环境中n-3和n-6 PUFAs的过氧化诱导铁死亡并介导抗癌作用

肿瘤酸中毒会通过刺激癌细胞中脂肪酸的代谢来促进疾病进展,“好的脂肪酸”,如Ω-3脂肪酸中,DHA/二十二碳六烯酸(docosahexaenoic acid)等对于大脑功能、视力以及机体炎症的调节至关重要。除此外,它们还与癌症发生率下降有关。有研究者逐步提出饮食是否可能通过调节肿瘤细胞对营养物质的获取和利用来影响癌症的进展,膳食omega-3(n-3)多不饱和脂肪酸(PUFAs)近年来因其潜在的抗癌作用而吸引了广泛的关注。本研究作者检测特定 FA 的过量摄取是否会导致抗肿瘤作用,发现在肿瘤酸中毒条件下,n-3 和 n-6 多不饱和脂肪酸 (PUFA) 选择性地诱导癌细胞中的铁死亡,提出膳食 LC-PUFA 作为一种辅助抗肿瘤方式,或将作为临床药物治疗的有效补充。
(1)选取宫颈 (SiHa)、结直肠 (HCT-116) 和下咽 (FaDu) 癌细胞系分别暴露于酸性PH(6.5/细胞)和中性PH(7.4/细胞)检测FAs,发现酸性6.5/肿瘤细胞FA的LDs积累总体增加,且LDs 的大小和数量与双键数量成比例增加(n-6 系列:C22:5,DPA > C20:4,ARA > C18:2,LA;n-3 系列:C22:6,DHA > C20:5,EPA > C18:3,ALA),通过针对CD36 抗体阻断酸中毒条件下 FA 的主要进入途径,从而显著减少了暴露于 DHA 时的 LDs 形成;
(2)n-3和n-6 PUFAs剂量依赖性地抑制了6.5/癌细胞的生长,而对相应的7.4/癌细胞没有抑制作用,选取FaDu和HCT-116癌细胞生成的3D肿瘤球体模拟自然酸中毒,检测PUFAs的细胞毒性,发现PUFAs的毒性作用再次与DHA和DPA的双键数量一致,并以酸性 pH 报告基因 pHLIP证实了球体核心部位在暴露于PUFA的后期发生了酸中毒,碘化丙啶 (PI) 检测细胞死亡,发现球体中心的细胞在暴露于 DPA 或 DHA后首先死亡,且碳酸氢盐中和H+后观察到 DPA 和 DHA 细胞毒性作用的消除;
(3)作者推断阻止PUFA 储存到 LDs 可以增强肿瘤酸性隔室中脂质过氧化的有害作用,使用二酰基甘油酰基转移酶(DGAT1)的抑制剂(DGAT1i),发现 DGAT1i能更有效地防止6.5/癌细胞中 LDs 的形成,同时DGAT1i加剧了6.5/癌细胞中 DHA 诱导的 MDA 生成,此外,DGAT1i 也增加了 DPA 和 DHA在酸适应癌细胞中的细胞毒性作用,发现DGAT 抑制及ferrostatin-1 和 liproxstatin-1两种铁死亡抑制剂都阻止了 DHA 和 DPA 在3D HCT-116和FaDu 肿瘤球体模型中的细胞毒性作用,表明DGATi 阻止 PUFA 缓冲到 LDs 是一种可行的策略;
(4)给小鼠喂食橄榄油或浓缩鱼油等热量饮食,发现鱼油富含 DHA 的饮食导致循环脂质中n-3 PUFA 的高度显著富集,给小鼠注射 HCT-116 癌细胞,发现鱼油富含 DHA饮食的小鼠肿瘤生长显著延迟,且DGAT1i能够进一步延迟DHA饮食小鼠的肿瘤生长,最后用铁死亡诱导剂或抑制剂治疗喂食富含 DHA 饮食的 HCT-116 荷瘤小鼠,富含 DHA 的饮食增加sulfasalazine 和Erastin的抗肿瘤作用,而ferrostatin-1却刺激肿瘤生长并显著降低了DHA饮食小鼠的存活率;
(5)本研究确立了肿瘤酸中毒与疾病进展之间的联系,通过增加侵袭性、耐药性和免疫逃逸,使得膳食 n-3 LC-PUFA 补充剂成为一个可行的肿瘤辅助治疗策略。
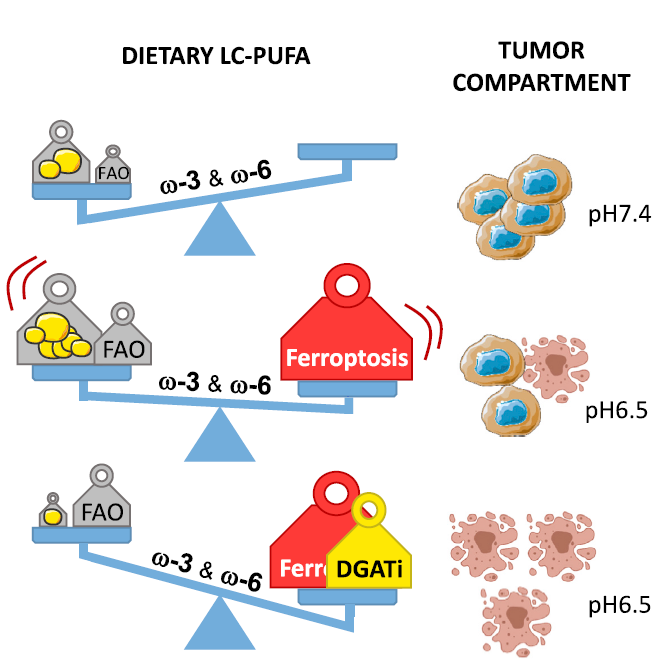
Peroxidation of n-3 and n-6 polyunsaturated fatty acids in the acidic tumor environment leads to
ferroptosis-mediated anticancer effects. Cell Metabolism. 2021. https://doi.org/10.1016/j.cmet.2021.05.016.
原文阅读,请长按识别下方二维码

六. Cell Reports | 高脂饮食激活脂肪酸氧化介导肠道干性和致瘤性

肥胖是一个明确的致癌因素,在哺乳动物肠道中,促肥胖高脂饮食(HFD)通过增加肠道干细胞(ISCs)的数量、增殖和功能来促进再生和肿瘤的发生,虽然PPAR(过氧化物酶体增殖物激活受体)核受体活性已被提出促进这些作用,但其确切作用尚不清楚。本研究设计系列实验证明HFD通过 PPAR-FAO(脂肪酸氧化)增强肠道干性和致瘤性,反之抑制 HFD 激活的 FAO途径将为预防 HFD 对 ISC 和肠道肿瘤的发生创造治疗机会。
(1)选取Vil-CreER(Ppard-iKO) , Pparanull,Ppardfl/fl (WT)给予他莫西芬处理并分别正常饮食(Control)和HFD饲喂28周,检测小鼠肠隐窝的干性类器官克隆性、Ppara和Pparg及其靶基因的表达,发现在体内功能丧失模型中,PPARα和PPARδ重叠地参与了肠干细胞和祖细胞的HFD反应,并用PPARα激动剂WY-14643和抑制剂GW6471进行干预,表明PPARδ和PPARα在支持肠道祖细胞适应HFD过程中具有独特和冗余的作用;
(2)从近端和远端小肠及结肠提取Control和HFD组小鼠单细胞进行RNA测序,发现HFD组中PPAR靶标和FAO基因如CPT1A高度富集且FAO下游产物乙酰肉碱和β-羟基丁suan(BOHB)上调,借助U13C-葡萄糖代谢流提示HFD ISCs和祖细胞中葡萄糖代谢减弱,表明HFD肠隐窝中FAO增强,葡萄糖代谢减弱;
(3)借助Cpt1afl/fl, Vil-CreER, Lgr5-eGFP处理的Control和HFD组,Cpt1a缺失抑制了HFD隐窝中干细胞/祖细胞的扩张和增殖,导致HFD隐窝中FAO含量及相关代谢物水平显著降低(如BOHB),BOHB是调节肠道干性和饮食反应的关键代谢物,在 HFD 中转向 FAO 是导致 ISC 中许多代谢和功能发生变化的原因;
(4)研究者首先提出HFD是否为利用肿瘤对 FAO的依赖性创造了某些治疗潜力,选取Apcfl/fl和Apc-iKO小鼠分别Control和HFD饲喂并给予他莫西芬处理,结果表明HFD在一定程度上通过将肿瘤细胞代谢转向FAO代谢,从而推动肠道肿瘤发生,并通过HFD状态下的FAO途径为预防或治疗肿瘤创造条件。
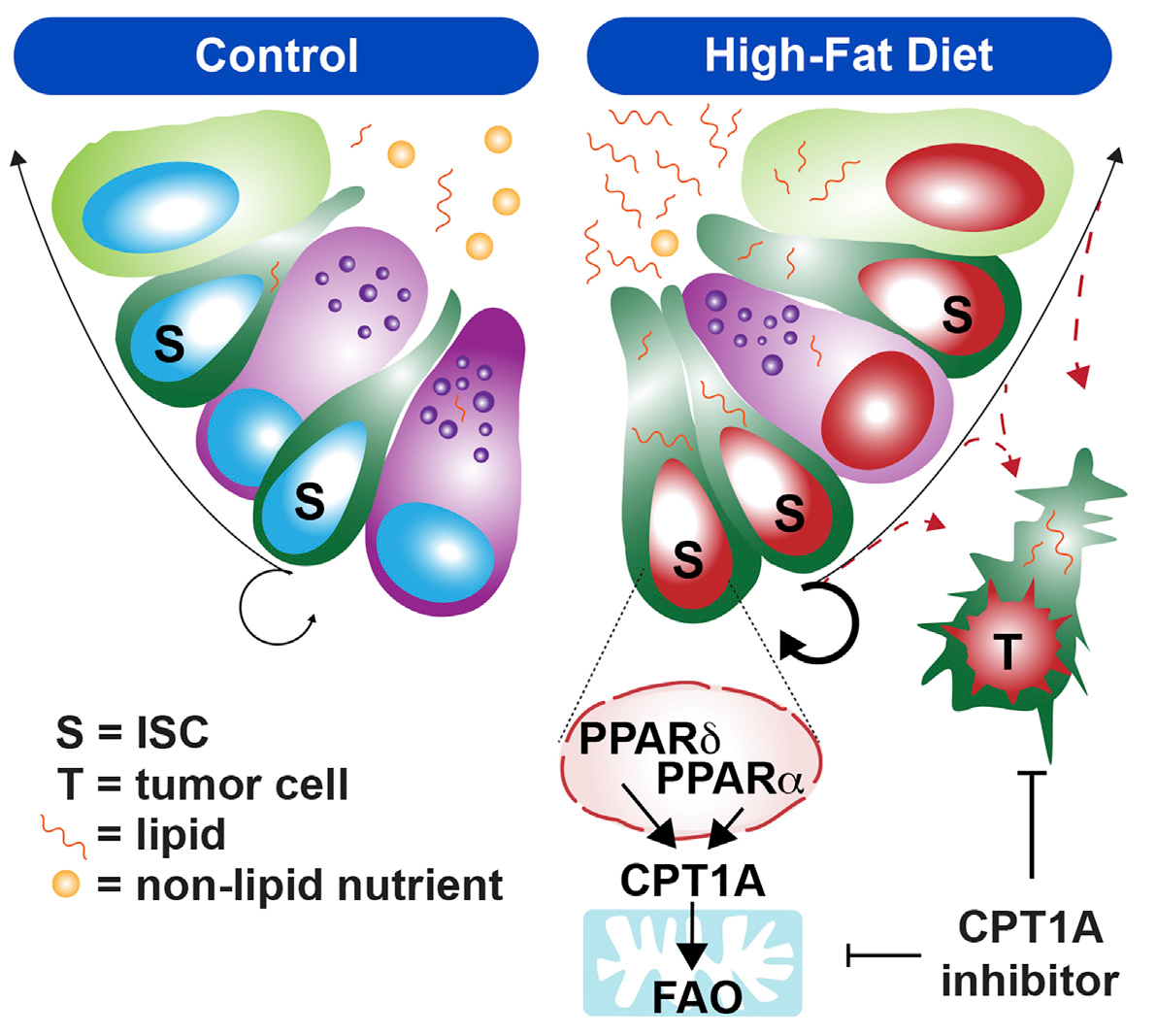
High-fat diet-activated fatty acid oxidation mediates intestinal stemness and tumorigenicity. Cell Reports. 2021. https://doi.org/10.1016/j.celrep.2021.109212.
原文阅读,请长按识别下方二维码

七. GUT | IgG4相关硬化性胆管炎和原发性硬化性胆管炎的粪便微生物组和代谢组分析

IgG4相关硬化性胆管炎(IgG4- SC)与原发性硬化性胆管炎(PSC)有多种临床相似之处。但皮质类固醇治疗对大多数 IgG4-SC 患者有效,而对 PSC 患者存在无效性。两种疾病的预后不同,PSC发生肝硬化、胆管癌和结直肠癌的风险高于IgG4-SC。这两种硬化性胆管炎的发病机制目前尚不清楚。虽然在PSC中肠道菌群失调已被广泛研究,但肠道菌群在IgG4- SC中的作用仍不清楚。本研究利用整合微生物组和代谢组数据,以描述粪便微生物和代谢概况中IgG4-SC相关和PSC相关的改变,并且评估肠道微生物组、代谢组和宿主之间的潜在功能联系疾病队列中的表型。
(1) 对135例患有IgG4- SC (n=34)、PSC (n=37)和健康对照(n=64)的粪便样本进行了16S rRNA基因扩增子测序。结果显示,与对照相比,两个疾病组的总体菌群组成均发现显著偏离;IgG4- SC和PSC中α 多样性降低。在菌群的改变上,IgG4- SC和PSC患者存在重叠,包括Fusobacterium、Lactobacillus和Veillonella增加,Oscillospiraceae UCG−002和Faecalibacterium减少;
(2)对113例患有IgG4- SC(n=31)、PSC (n=37)和健康对照(n=45)进行粪便样本的非靶向代谢组学分析,OPLS - DA显示IgG4- SC和PSC的代谢组成与对照组显著偏离。琥珀酸在这两种疾病中显著增加。在比较IgG4- SC和PSC组时,有4种代谢物存在显著差异;
(3) 将代谢组和16S结果进行联合分析,结果显示,L-棕榈基肉碱在两种疾病组中都升高,且与Eubacterium coprostanoligenes 和 Lachnospiraceae NK4A136呈负相关;羟基异己suan与Streptococcus呈正相关。与临床指标进行相关性分析,结果显示,在IgG4-SC中,患者中差异菌群和代谢物与转氨酶显著相关,而PSC中菌群和代谢特征的改变与胆汁淤积表型相关;
(4)建立随机森林模型来区分IgG4- SC、PSC和HC,以探讨肠道微生物和代谢谱在疾病预测中的潜在应用价值,采用五折交叉验证随机森林模型筛选关键菌群或代谢物,鉴定出由 10 个属组成的肠道微生物组特征,可将 IgG4-SC 与 HC 区分开来,AUC(曲线下面积) 为 0.81;基于7种代谢物的模型优于微生物特征的模型,AUC为0.94。总之,基于粪便代谢物的预测模型在区分疾病状态方面比基于微生物群的预测模型表现更好。该研究揭示了两种疾病在宿主-微生物互作中的相似和不同之处,为深入探索发病机理提供了新线索。
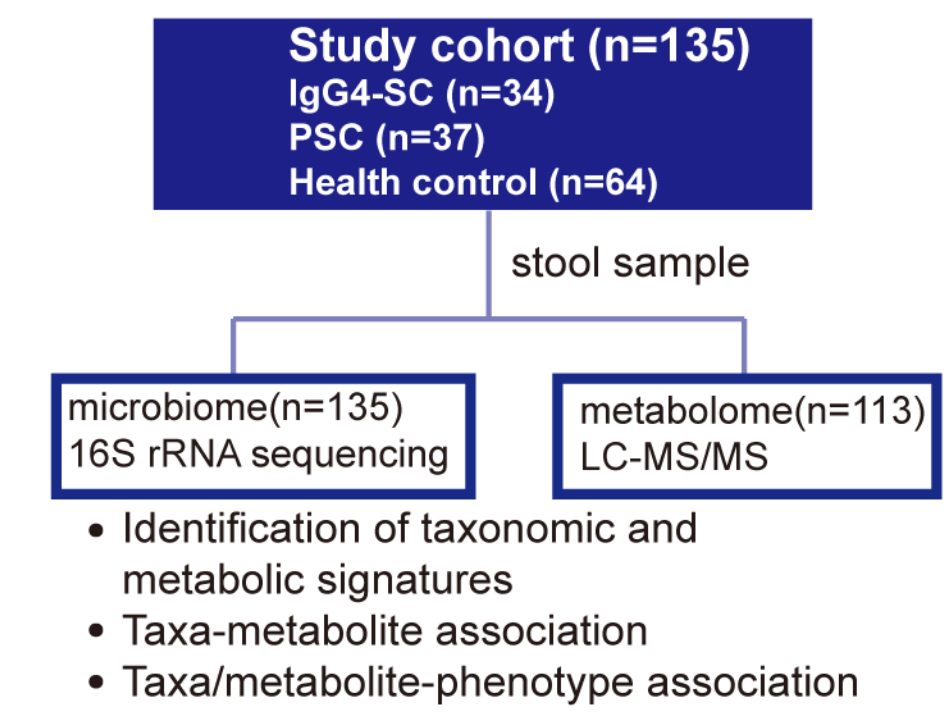
Altered faecal microbiome and metabolome in IgG4-related sclerosing cholangitis and primary sclerosing cholangitis. GUT. 2021. https://doi.org/10.1136/gutjnl-2020-323565.
原文阅读,请长按识别下方二维码

八. Nature Communications | 婴儿呼吸道合胞病毒(RSV)毛细支气管炎与儿童哮*风险的多组学内型研究

呼吸道合胞病毒毛细支气管炎是美国婴儿住院的主要原因,且30%因毛细支气管炎住院的婴儿随后在儿童时期发展为哮*。在主要致病菌中,婴儿期呼吸道合胞病毒(RSV)感染在哮*发展中占人口比例最大。虽然最近研究表明了RSV毛细支气管炎的临床异质性,但对其生物学上独特的内型知之甚少。本研究整合了临床、病毒、气道微生物瘤多中心前瞻性队列研究中的毛细支气管炎RSV患儿的种级、转录体和代谢组数据,为在气道发育的关键时期早期识别高危儿童提供了证据基础。
(1)本研究分析了一项多中心前瞻性队列研究的数据,这项前瞻性队列研究在美国14个州的17个地点完成了1016名因毛细支气管炎住院的婴儿(年龄< 1岁)的登记。在纳入该纵向队列的婴儿中,包括221例RSV毛细支气管炎婴儿,他们被随机选择进行鼻咽微生物组、转录组和代谢组检测;
(2)对临床、病毒、鼻咽部气道微生物组、转录组和代谢组数据应用了整合网络和聚类方法,并结合平均轮廓得分、网络模块性、内型大小以及临床和生物学的合理性,以获得临床和生物学上不同的RSV内型,最终确定4种具有生物学和临床意义的内型;
(3)A型婴儿的特征是毛细支气管炎的“典型”临床表现,包括年龄小,以前有呼吸问题和父母哮*的比例低,单独呼吸道合胞病毒感染的比例高,M.nonliquefaciens的丰度高,IFN-α反应中等。B型婴儿的特点是父母哮*、IgE超敏和鼻病毒合并感染的比例高,肺炎链球菌和卡他莫拉菌丰度高,以及IFN-α反应高。C型婴儿的特点是高比例的抗生素使用,菌群紊乱和IFN-α反应低。D型婴儿的特点是低比例的父母哮*和IgE敏感,M.catarrhalis丰度增高、IL-6水平增高;
(4) 比较A型和其他类型毛细支气管炎的结局风险,以研究它们与临床结果的纵向关联,结果显示,与A型婴儿相比,B型婴儿在5岁时发生哮*的风险显著更高,而内型C或D的患者没有显著风险差异;
(5)从个体和综合两方面比较鼻咽部微生物组、转录组和代谢组,以便更好地了解最低风险组(A型)和最高风险组(B型)之间的差异,结果显示,与A型婴儿相比,B型婴儿肺炎链球菌丰度较高。这些内型之间的宿主转录组表达谱不同,共有29个差异表达基因。在通路分析中,B型婴儿有24个差异富集的通路,如IFN-α通路上调。对转录组和代谢组数据的综合分析也表明,共有155条差异通路,其中B型的pi3k-akt-mtor信号通路显著富集;
(6)在检测稳健性的敏感性分析中,与A型相比,B型婴儿患哮*的风险显著升高和*息复发率升高。差异基因表达分析显示,与与A型相比, B型婴儿也组中的IFN-γ和NFκB通路也显著富集。与A型相比,B型婴儿在5岁时患哮*的风险明显更高,且哮*复发率也较高。本研究为早期识别气道发育关键时期的高危儿童提供了证据基础。
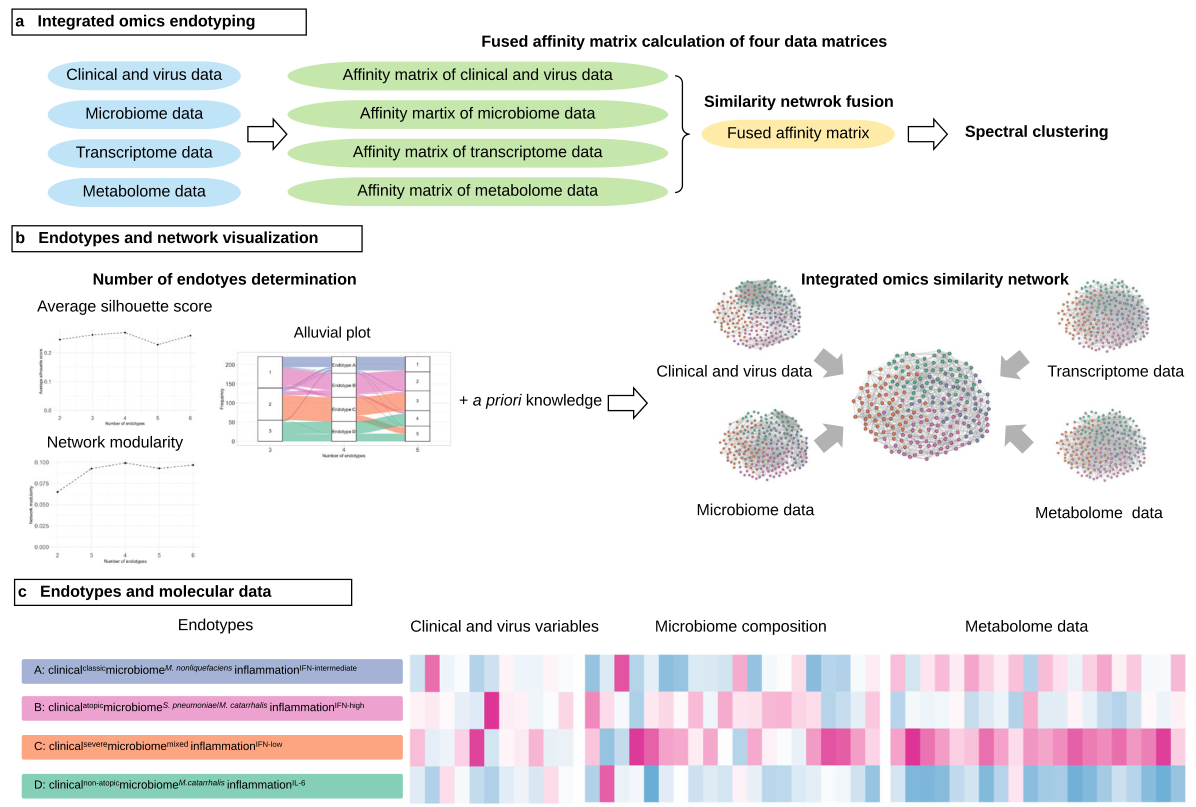
Integrated omics endotyping of infants with respiratory syncytial virus bronchiolitis and risk of childhood asthma. Nature Communications. 2021. https://doi.org/ 10.1038/s41467-021-23859-6.
原文阅读,请长按识别下方二维码

九. Cell Metabolism | 机械诱导的细胞代谢促进MT谷氨酰化以应答癌症信号

来自肿瘤微环境的机械信号调节细胞力学并影响细胞代谢以促进癌症侵袭。细胞通过调整其细胞骨架的硬度来承受外力。微管 (MT)充当受压元件。然而癌细胞如何响应局部受限环境来调节MT动态机制仍不清楚。基于此,法国蔚蓝海岸大学的Thomas Bertero和Stéphanie Torrino等研究人员,发现机械诱导的细胞代谢促进MT谷氨酰化以迫使转移。
(1)细胞外基质 (ECM) 硬化增加了微管蛋白的扩散速率并降低了微管蛋白的可移动部分,同时降低了MT的生长速率,表明ECM硬化稳定了MT。并且增加了 MT谷氨酰化并重组了MT网络;
(2)MT谷氨酰胺化依赖于谷氨酰胺,用CB839(谷氨酰胺酶抑制剂)对谷氨酰胺酶(GLS)进行药理学抑制作用会降低 MT谷氨酰化并影响其机械稳定性。代谢组学和代谢途径分析显示,ECM硬化显著调节了33种代谢物的稳态水平,这些代谢物在与氨基酸代谢(天冬氨酸、谷氨酸、精氨酸和脯氨酸)相关的途径中高度富集。在细胞内谷氨酸/谷氨酰胺比率显著的增加,当细胞在基质变硬时增加其谷氨酰胺摄取率。还观察到在刚性基质上培养的细胞中GLS表达和活性增加。这些结果支持谷氨酰胺的摄取和分解代谢调节细胞内谷氨酸池以维持机械应力下MT谷氨酰胺化的观点。而过表达缺乏谷氨酰化位点的MT突变体降低了其谷氨酰化及稳定性,从而阻碍了体外和体内癌症的侵袭性;
(3)接着进行siRNA筛选,以确定TTLL和CCP酶家族成员负责MT谷氨酰胺化对机械应力的反应。发现MT谷氨酰胺化的调节影响MT在细胞中的动力学和稳定性。由此确定在对基质硬化的反应中,MT谷氨酰胺化由TTLL4和CCP5协调,并且是稳定MTs所必需和足够的;
(4)研究人员使用乳腺癌作为机械信号促进疾病进展的疾病模型,表明基质硬化重新连接谷氨酰胺代谢以促进MT谷氨酰胺化并强制MT稳定,从而促进细胞侵袭。
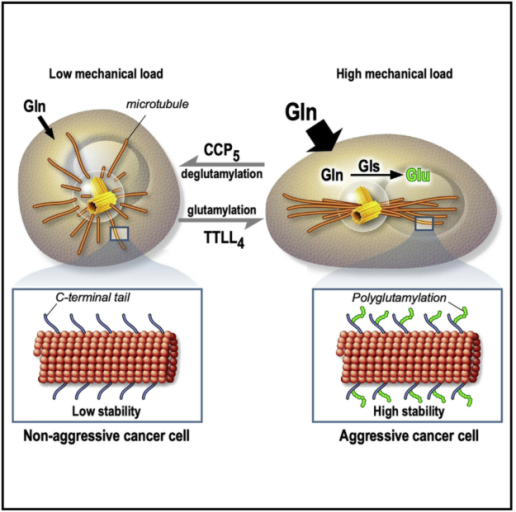
Mechano-induced cell metabolism promotes microtubule glutamylation to force metastasis. Cell Metabolism. 2021. https://doi.org/ 10.1016/j.cmet.2021.05.009.
原文阅读,请长按识别下方二维码

十. Cell Metabolism | 肠道菌群代谢产物通过调节细胞毒性CD8+ T细胞免疫促进抗癌治疗效果

近年来,肿瘤免疫疗法已成为临床上治疗癌症的有力手段,并引发了癌症疗法的范式转变。CD8+ T细胞在肿瘤免疫中起核心作用,促进CD8+ T细胞在肿瘤微环境(TME)中的浸润和功能可能有助于提高癌症治疗的疗效。对小鼠和人类的研究表明,肠道微生物群可以调节肿瘤对化疗或免疫治疗的反应,将对PD-1阻断有效的患者粪便菌群移植到无效患者中,能够增强PD-1抗体治疗的疗效。肠道微生物群可以合成许多特定的代谢物,一些代谢物可以影响癌症的发展和系统免疫反应。而肠道微生物如何调节远端抗肿瘤免疫力,以及肠道菌群是否能调节肿瘤浸润性CD8+ T细胞应答尚不完全清楚。本研究发现肠道微生物代谢产物,特别是丁suan盐,可以通过调节CD8+ T细胞在肿瘤微环境中的作用来提高奥沙利铂的疗效。
(1)研究人员发现口服抗生素可以破坏化疗药奥沙利铂的抗癌疗效,向抗生素处理小鼠回输肠道菌群代谢物,可以提高肿瘤微环境中CD8+ T细胞的浸润和功能,进而促进化疗药物的疗效,表明肠道菌群可以通过其代谢产物影响机体抗肿瘤免疫应答以及治疗效果;
(2)代谢组学分析显示抗生素处理导致小鼠肠道内的微生物代谢产物组成发生变化,其中短链脂肪酸丁suan的含量显著降低。同时,丁suan能够显著提高CD8+ T细胞中干扰素-γ(IFN-γ)的表达。表明丁suan盐可能介导肠道微生物群的抗癌作用;
(3)为了进一步证实丁suan对CD8+ T细胞的直接作用,对卵清蛋白(OVA)特异性的OT-I CD8+ T细胞进行体外活化,并给予低剂量(1 mM)丁suan过夜处理。结果显示丁suan处理可以直接调节CD8+ T细胞的功能,促进抗肿瘤免疫;
(4)机制上,丁suan对肿瘤浸润性CD8+ T细胞的促进作用需要ID2。ID2在CD8+ T细胞的肿瘤浸润和功能中起着至关重要的作用,ID2通过调节IL-12信号通路促进CD8+ T细胞的细胞毒性功能,丁suan通过调节ID2依赖的IL-12通路提高CD8+ T细胞的功能;
(5)研究人员发现含丁suan盐饲料或丁suan盐腹腔注射均能促进奥沙利铂或PD-L1抗体的抗肿瘤疗效。通过收集奥沙利铂治疗后的
