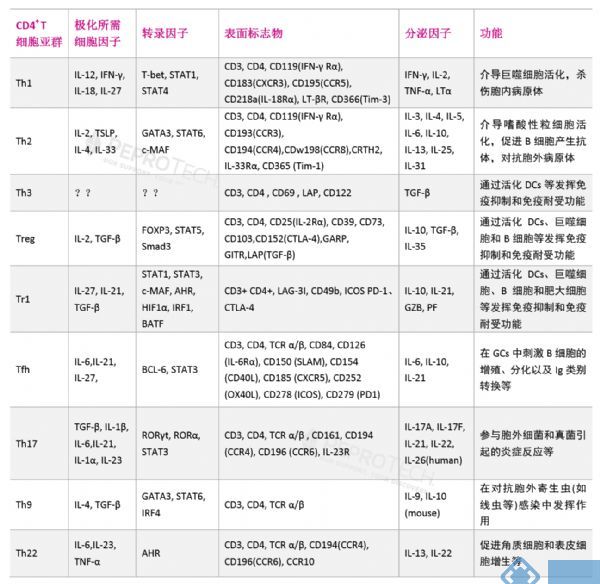
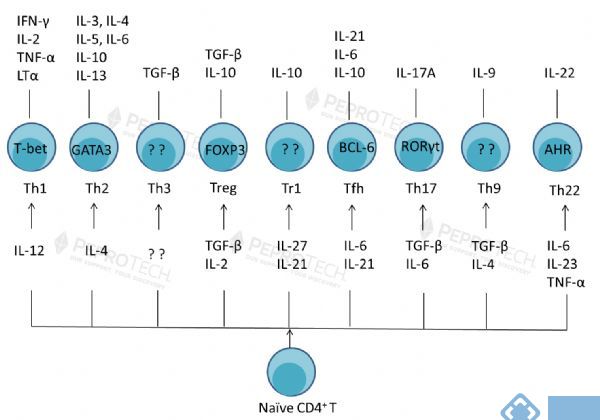
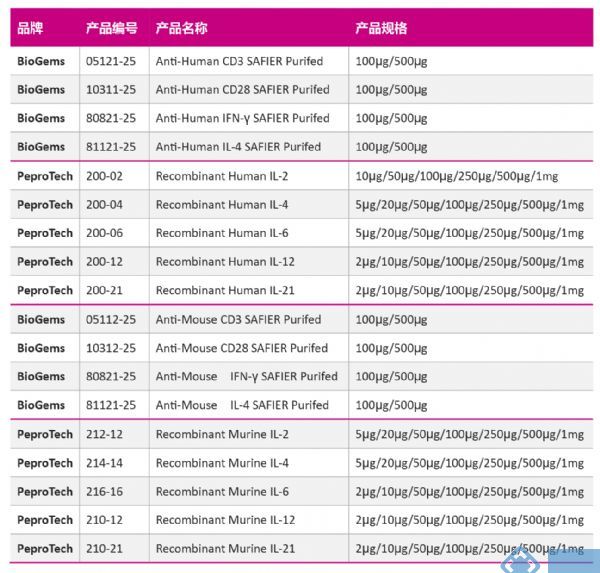
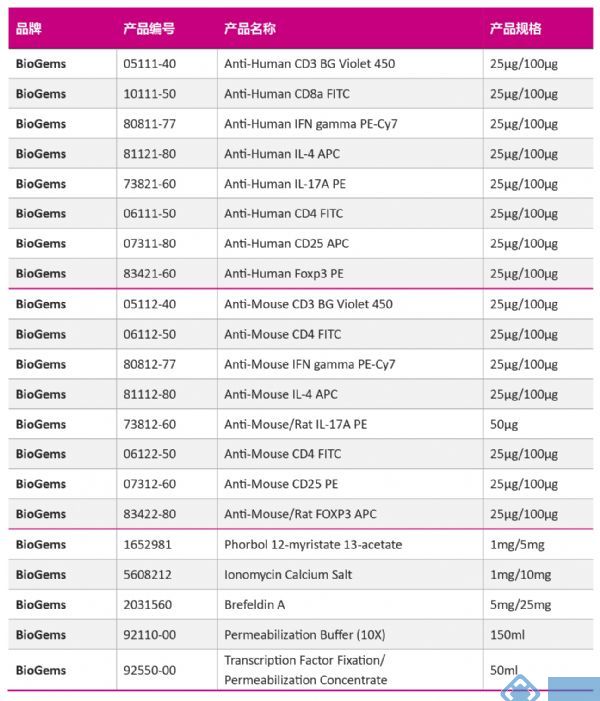
免疫细胞的家族成员-Th亚群
作者:美国PeproTech(派普泰克)公司中国代表处 2020-04-20T00:00 (访问量:13157)
美国PeproTech(派普泰克)公司中国代表处 商家主页
地 址:  江苏省苏州市工业园区星湖街218号A1北座4楼L03
联系人: PeproTech
电 话: 0512-68325983,4000053055
传 真: 0512-68325993
Email:peprotech.infochina@thermofisher.com
相关咨询
PeproTech 2020年8月发布Murine BRAK (CXCL14) (250-45)、Murine GPR15L (300-72)、Human Tissue Factor (150-19T) 3种新品! (2020-08-19T16:03 浏览数:8152)
PeproTech 2020年6月发布Rabbit Anti-Human SCGF-α、Bovine FGF-basic等5种新品! (2020-06-04T10:51 浏览数:8176)
别样开学季,抓紧赶上这班“88元购”列车吧~ 20天倒计时! (2020-04-10T10:08 浏览数:10846)
PeproTech第一堂公开课开讲啦! (2020-03-25T16:44 浏览数:7357)
查收这份开学促销指南,PeproTech与您一起等待春暖花开! (2020-03-02T11:56 浏览数:9116)
88元购 PeproTech细胞因子,别样开学季,我们隔空相“惠”! (2020-03-02T11:03 浏览数:6745)
PeproTech 2020年1月发布Murine Artemin、PeproGMP® Recombinant Human IL-15等4种新品! (2020-01-07T13:55 浏览数:7854)
PeproTech 2019年12月发布Murine IL-17E、PeproGrow™ hESC Plus (Embryonic Stem Cell) Media 2种新品! (2019-12-06T13:35 浏览数:7167)
聚焦细胞治疗,PeproTech与您相约中国疾病细胞&生物治疗大会 (2019-11-21T15:47 浏览数:7608)
PeproTech 2019年11月发布Rat IL-21、Human Exodus-2 2种新品! (2019-11-05T17:14 浏览数:8649)