大家是不是都面临这样的场景:辛苦处理的细胞,担心冻存对结果有影响,熬夜立马实验?病房外焦急等待手术样本,拿到样本后马不停蹄奔向实验台?野外采集的样本,恨不能将实验台搬到田野?
铛铛铛铛,冻存样本处理protocol放送了!
(Tips:细胞冻存或者组织冻存时,建议放在液氮中保存,这样样本存储时间更久,得到的结果更好哦!)
01
冻存细胞预处理
1.1实验前准备
1.在开始细胞解冻前,将水浴锅设置为37℃;
2.准备约50 mL温热(37℃预热)的RPMI-1640 +10% FBS培养基;
3.离心机打开设置4℃,300 g,5 min。
1.2冻存样本复苏实验步骤
1.从-80℃冰箱或液氮中取出冻存管,并立即于37℃水浴锅快速晃动解冻,直到冻存管内的试剂完全融化(整个过程在1-2 min内完成)。
2.从水浴中取出冻存管,用酒精棉对冻存管口及外表面进行消毒;
3.将细胞样本连同冻存液一起转移至新的15 mL离心管中,加入5 mL预热的细胞完全培养基RPMI-1640 +10% FBS,轻柔吹打将液体混合均匀;
4.室温300 g,离心5 min,弃上清(担心细胞被吸到可留5-10 μL的上清);
5.离心后弃去上清,根据细胞量加入150 μL预冷的RPMI1640培养基重悬,取5μL 细胞悬液加入15 μL 的AO/PI染色,细胞计数及细胞活性;
6.如细胞活率大于80%,有核率大于70%,背景干净可以直接进行下游实验。(若细胞活性较低,也可正常提核,但是后续ATAC实验结果可能出现重复率不高的情况,需根据实验室自己的项目情况来具体评估)。
1.3
ATAC实验-细胞收集
1.获细胞并计数:取实验所需数量的细胞(5万左右)于 1.5 mL EP 管中,4℃ 2,300 rpm (500 × g)离心 5 min,吸净管内溶液。
【注】:对于大小不同的细胞,请根据实际情况调整离心力。
2.每个样本加入 50 μL 预冷的 Wash Buffer 重悬细胞,4℃ 2,300 rpm (500 × g)低速离心 5 min,吸净管内溶液。
3.每个样本中加入 50 μL Lysis Buffer,轻轻吹打重悬,冰上放置 5 min,4℃,2,300 rpm (500 × g)离心 5 min,去除上清。

4.直接进行后续的转座反应。
02
冻存组织预处理
样本处理
1. 将冻存小鼠肝脏组织从-80℃取出放于培养皿中,用刀片切下绿豆粒大小(约30mg)组织,随后立即将培养皿放置冰上。
2. 组织大部分融化后,加入1mL预冷的PBS清洗小鼠肝脏组织,用移液器吸去PBS,共清洗3次。
3. 清洗完成的肝脏组织可以采用以下两种处理方式提取细胞核,客户可根据实际情况自行选择。
·
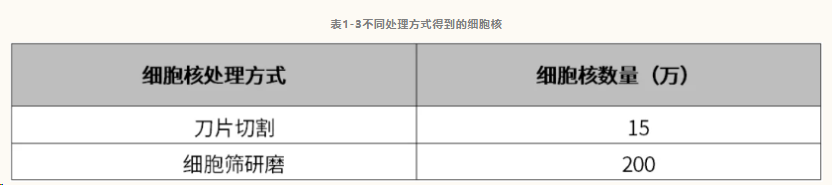
方案一:将培养皿至于提取预冷的金属块上,在培养皿中,用刀片将组织切碎成颗粒状(芝麻大小),加入600 μL预冷的Lysis Buffer,冰上静置10 min。随后用40 μm细胞筛过滤切碎的组织至1.5mL EP管中,4℃,300 g离心5 min,去上清,用200 μL预冷的PBS重悬细胞核沉淀。取18 μL细胞核悬液,加入2 μL 0.4%台盼蓝溶液染色,显微镜下镜检,用血球计数板计算细胞核的浓度。(刀片切割:细胞核悬浮液体积200 μL,细胞核浓度约750个/μL;细胞筛研磨:细胞核悬浮液体积1000 μL,细胞核浓度约2000个/ μL)。根据计数结果,取50000细胞核悬液,加50 μL预冷的PBS,4℃,300g离心3 min去除上清,收集细胞核。
·
·
方案二:取一个干净的50 mL离心管,插入冰中,去掉管盖,将40 μm细胞筛放在管口,用镊子将培养皿中清洗完成的组织放置于细胞筛中央处。取少量预冷的PBS(200 μL左右,覆盖组织块即可)滴加到组织处,用注射器黑色的活塞头轻轻的研磨分散组织(研磨2圈后,观察组织分散情况,每研磨2圈加入500 μL-1000 μL预冷的PBS冲洗组织块,总计研磨4-6圈左右,此时,50 mL离心管中溶液呈乳白色,细胞筛表面有一层组织覆盖)。将离心管中溶液转至1.5 mL EP管中,4℃,300 g离心5 min,去上清,用600 μL预冷的Lysis Buffer重悬细胞核沉淀,冰上静置5min。4℃,300 g离心5min,去上清,用1000 μL预冷的PBS重悬细胞核沉淀,随后用40 μm细胞筛过滤重悬后的细胞核至1.5 mL EP管中。
·

4. 取18 μL细胞核悬液,加入2 μL 0.4%台盼蓝溶液染色,显微镜下镜检,用血球计数板计算细胞核的浓度。(刀片切割:细胞核悬浮液体积200 μL,细胞核浓度约750个/μL;细胞筛研磨:细胞核悬浮液体积1000 μL,细胞核浓度约2000个/ μL);
5. 根据计数结果,取50000细胞核悬液,加50 μL预冷的PBS,4℃,300g离心3 min去除上清,收集细胞核;
6. 处理好的细胞核立即进行Tn5转座法DNA建库。
03
ATAC-seq建库实验
3.1
ATAC实验-转座酶片段化(0.5 h-1 h)
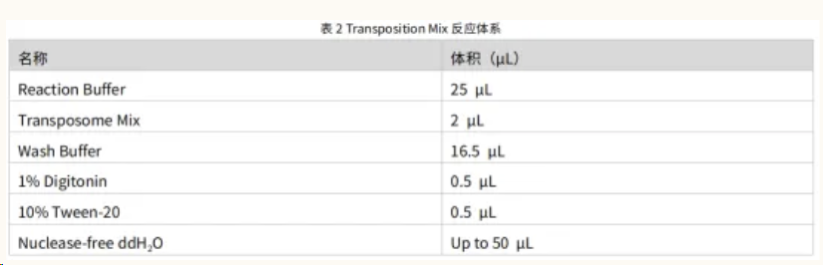
1.于无菌 PCR 管中配制表 2 所示反应体系,配制好后冰上放置;
2. 将配制好的 Transposition Mix 加入到处理好的细胞核中,使用移液器轻轻吹打 5-8 次混匀;
【注】:吹打时尽量轻柔缓慢,不要产生气泡,否则会对细胞核造成损伤。也不要离心,否则会导致细胞核聚集,导致片段化不充分。
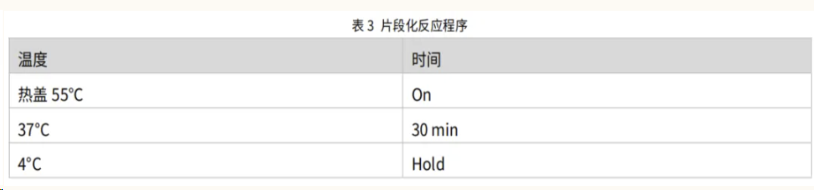
将上述 PCR 管置于 PCR 仪中,设置表 3 所示反应程序,进行片段化反应。
4. 将反应结束后的 PCR 管瞬离,立即向每个样本中加入 5 μL 的 Terminate Solution,用移液器轻柔吹打 20 次混匀,室温静置 5 min。
3.2
ATAC实验-基因组 DNA 回收(0.5 h)
1. 将平衡至室温的 DNA Extract Beads 磁珠,涡旋振荡混匀;
2. 吸取 130 μL DNA Extract Beads 至 55 μL 终止后的片段化产物中,涡旋混匀或用移液器吹打混匀 10 次,室温静置孵育5 min;
3. 短暂离心,将离心管置于磁力架上静置 3 min,待磁珠完全贴壁后吸净 PCR 管中溶液;
4. 保持 PCR 管始终处于磁力架上,从另一侧加入 200 μL 80%乙醇,避免直接冲洗磁珠,静置 30-60 sec,吸净 PCR 管中溶液;
5. 保持 PCR 管始终处于磁力架中,再次加入 200 μL 80%乙醇,静置 30-60 sec,吸净 PCR 管中溶液;
6. 保持 PCR 管始终处于磁力架中,开盖空气干燥至磁珠刚刚出现龟裂(不超过 3 min);
7. 从磁力架上取下 PCR 管,加入 25 μL ddH2O,并充分涡旋,室温静置 5 min;
8. 将 PCR 管短暂离心并置于磁力架上分离磁珠和液体,待溶液澄清后(约 3-5 min),小心转移 23 μL 上清至新的 PCR 管中, 进行后续的文库扩增或者-20℃保存。
3.3
文库扩增(0.5 h-1h)
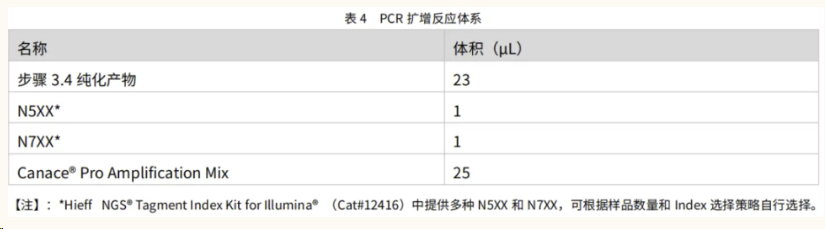
1. 将表 4 中试剂解冻后颠倒混匀,瞬离后置于冰上备用;
2. 于无菌 PCR 管中配制表 4 所示反应体系;
3. 使用移液器轻轻吹打或振荡混匀,并短暂离心将反应液收集至管底;
4. 将 PCR 管置于 PCR 仪中,设置表 5 所示反应程序,进行 PCR 扩增。

3.4
文库分选(0.5 h)
由于起始细胞量以及不同种类细胞的染色质开放状态差异,文库大小可能存在不同的分布模式。通过磁珠分选,文库中的大 片段可以有效去除,使得文库片段分布在 200-700 bp 左右。
1. 进行双轮分选的比例推荐 0.55×/1.0×,吸取 27.5 μL (0.55×Beads:DNA=0.55:1)平衡至室温的 DNA Clean Beads 至步骤 5.5 的 PCR 反应产物中,涡旋混匀或用移液器吹打混匀 10 次,室温静置孵育 5 min;
2. 短暂离心,将 PCR 管置于磁力架上静置 5 min,待溶液澄清后,小心转移上清至新的 PCR 管中(残留 3-5 μL,避免吸到磁珠);
3. 涡旋振荡混匀 DNA Clean Beads 并吸取 50 μL(1.0×,Beads:DNA=1:1)至上清中,涡旋混匀或移液器吹打混匀 10 次, 室温静置孵育 5 min;
4. 短暂离心,将 PCR 管置于磁力架上静置 3 min,待磁珠完全贴壁后吸净 PCR 管中溶液;
5. 保持 PCR 管始终处于磁力架上,从另一侧加入 200 μL 80%乙醇,避免直接冲刷磁珠,静置 30-60 sec,吸净 PCR 管中 溶液;
6. 保持 PCR 管始终处于磁力架上,再次加入 200 μL 80%乙醇,静置 30-60 sec,吸净 PCR 管中溶液;
7. 保持 PCR 管始终处于磁力架上,开盖空气干燥至磁珠刚刚出现龟裂(不超过 3 min);
8. 从磁力架上取下 PCR 管,加入 21 μL ddH2O,并充分涡旋,室温静置 5 min;
9. 将 PCR 管短暂离心,置于磁力架上分离磁珠和液体,待溶液澄清后(约 3-5 min),小心转移 20 μL 上清至新的 EP 管中,于-20℃保存。
3.5
文库质量控制
通常情况下,对构建好的文库进行浓度和长度分布检测,具体请参见注意事项,主要包括:
a. 浓度检测:用 Qubit 对文库的浓度进行检测。
b. 质量检测:用 Qsep 或者安捷伦 2100 检测文库片段分布。
04
产品推荐
产品推荐
|
产品名称 |
货号 |
规格 |
|
Hieff NGS® ATAC-Seq Library Prep Kit for Illumina®ATAC建库试剂盒 |
12 T/ 48 T |
|
|
Hieff NGS® Tagment Index Kit for Illumina®Tn5建库专用接头 |
48 T/ 192 T |
|
|
1×dsDNA HS Assay Kit |
100 T/500 T |
|
|
Qubit专用检测管 |
500支/5000 支 |
|
|
PCR金属磁力架 |
个 |
