
发表期刊:Journal of Experimental & Clinical Cancer Research
影响因子:12.658
发表时间:2022年1月28日
研究方法:m6A MeRIP-seq、RNA-seq、MeRIP-qPCR、RIP-qPCR
文章链接:FTO suppresses glycolysis and growth of papillary thyroid cancer via decreasing stability of APOE mRNA in an N6-methyladenosine-dependent manner

技术路线
01 PTC中m6A修饰异常,FTO表达下调
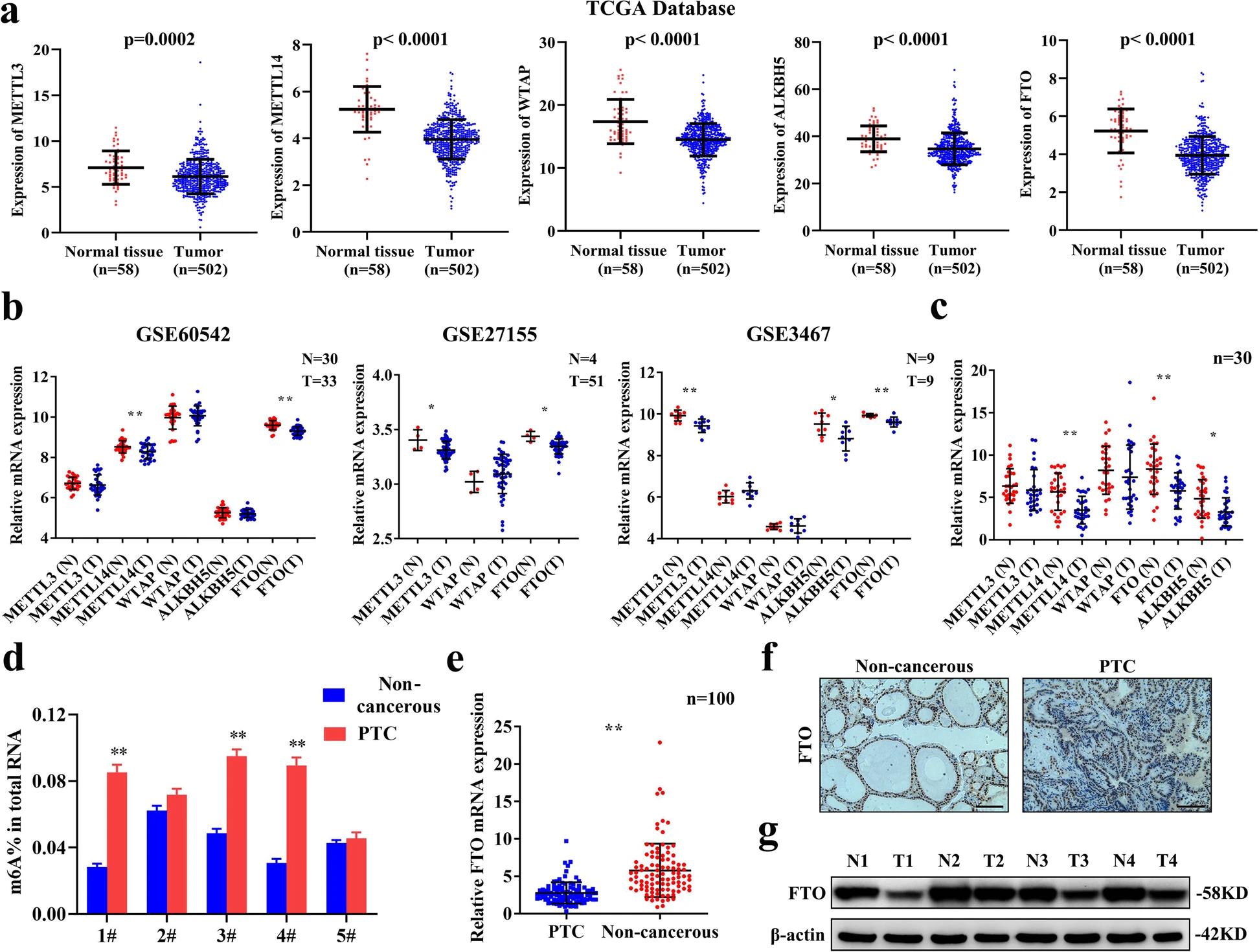
为了探索m6A修饰在PTC中的作用,作者首先利用TCGA和GEO等公共临床数据库,比较了m6A修饰相关酶在PTC组织和正常甲状腺组织中的表达水平。TCGA数据集(图1.A)和GEO数据集(图1.B)分析显示,与正常组织相比,PTC组织中去甲基化酶FTO的基因表达显著下调。作者进而通过qRT-PCR检测了30对(图1.C)和100对(图1.E)PTC组织样本,结果同样显示,在PTC组织中FTO基因表达下调。且与去甲基化酶表达下调一致,PTC组织中m6A的总体水平高于配对非癌组织(图1.D)。免疫组化法(图1.F)和免疫印迹分析(图1.G)结果显示,PTC组织中FTO蛋白表达下调。这些结果表明,FTO在PTC中基因及蛋白表达水平均显著下调,并可能通过m6A修饰调控PTC的进展。
02 FTO在体内、体外抑制PTC肿瘤生长
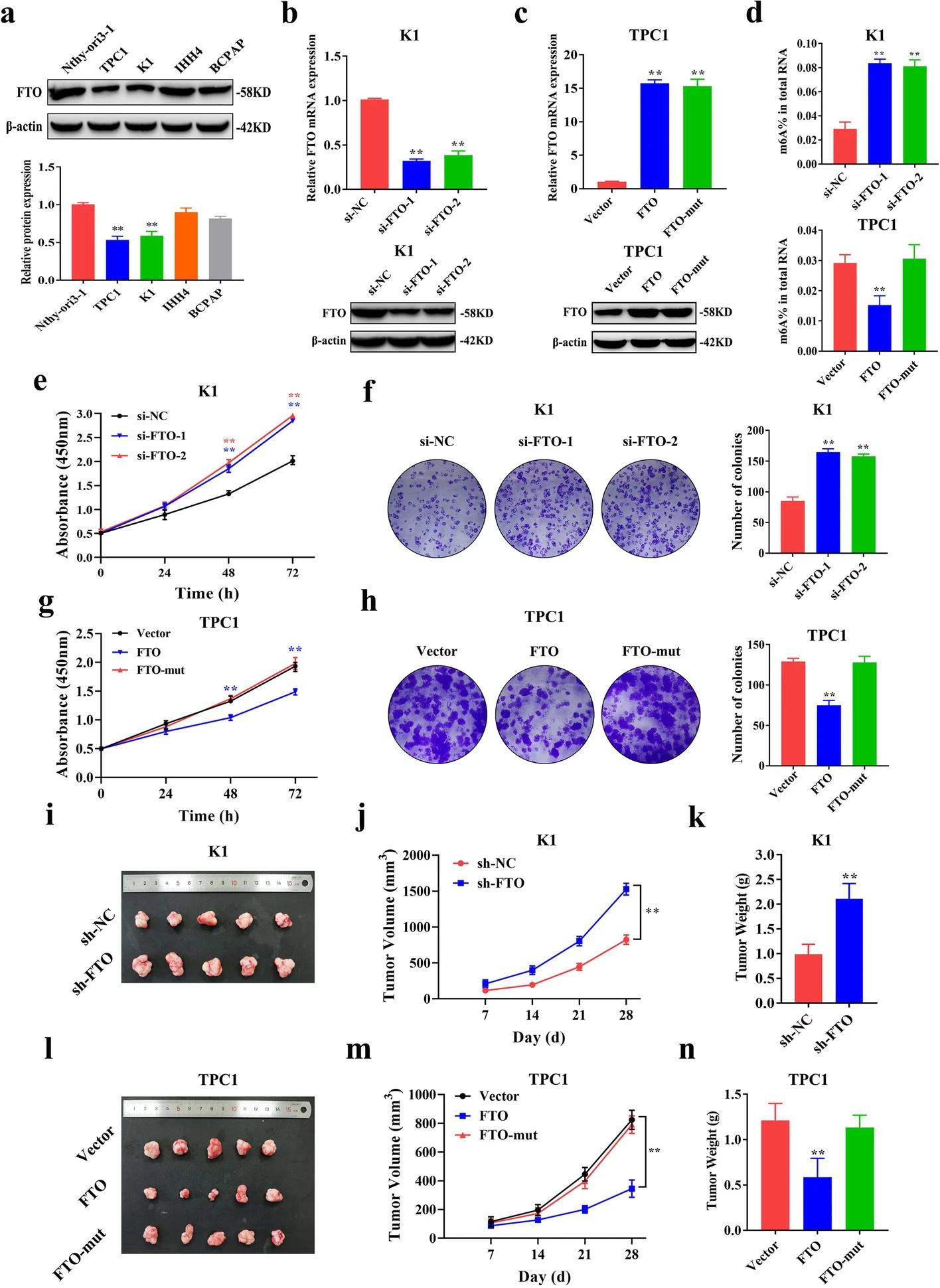
作者检测了FTO在正常人甲状腺滤泡上皮细胞系Nthy-ori3-1和4种PTC细胞系(K1、BCPAP、IHH4和TPC1)中的相对表达,结果显示IHH4和BCPAP中FTO的表达量略低于Nthy-ori3-1细胞系(图2.A)。因此,与PTC组织中FTO的表达趋势一致的KI和TPC1细胞系被运用于后续研究。作者首先通过qRT-PCR和WB验证了FTO敲低和FTO过表达的有效性(图2.B-C)。进一步的研究结果显示,FTO的敲低或过表达分别增加或降低了PTC细胞的整体m6A修饰水平(图2.D)。而CCK-8检测和集落形成检测结果显示,FTO敲低显著促进了PTC细胞的增殖(图2.E-F)。此外,研究表明,过表达FTO抑制了PTC细胞的增殖,而过表达FTO-mut (去甲基化结构域缺失)无细胞增殖(图2.G-H),暗示FTO诱导的PTC增殖依赖于其去甲基化酶的功能。进一步体内实验结果显示,在异种移植小鼠模型中,敲低或过表达FTO显著增加或降低了肿瘤的生长和肿瘤重量(图2.I-N)。然而,在过表达FTO-mut后,在体内未观察到FTO对肿瘤生长的影响(图2.L-N),表明FTO通过其去甲基化结构域抑制PTC肿瘤生长。
03 FTO通过调节糖酵解来抑制PTC的生长
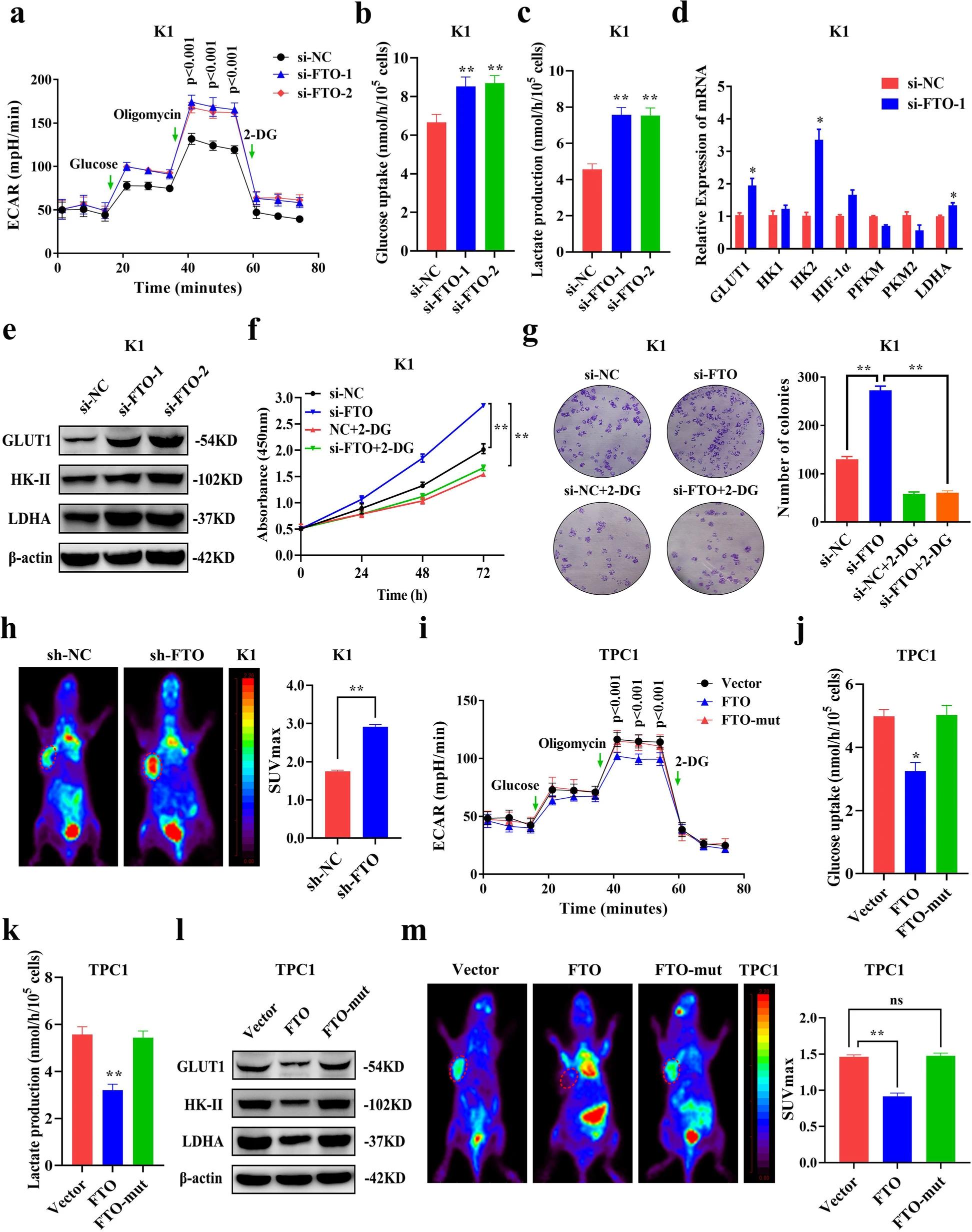
FTO可以通过控制能量消耗来维持能量稳态。为了确定FTO对PTC糖酵解代谢的调控作用,作者通过ECAR代谢分析,发现FTO敲低显著增加了K1和TPC1细胞中ECAR水平(图3.A),表明其可抑制PTC中的糖酵解。糖酵解产生大量的乳酸,并且糖酵解中间体可能被转移到各种生物合成途径中。体外实验分析显示,在FTO敲低后,PTC细胞的葡萄糖摄取和乳酸产量显著增加(图3.B-C),而过表达FTO显著降低了PTC细胞中的ECAR水平、葡萄糖摄取和乳酸生成(图3.I-K)。作者进一步测定了FTO敲低后糖酵解中关键酶的表达水平,来分析糖酵解的调控机制。QRT-PCR(图3.D)和免疫印迹法(图3.E)结果显示,在FTO敲低后,K1细胞中,GLUT1、HK-II和LDHA 基因和蛋白表达水平显著上调,而过表达FTO后,GLUT1、HK-II和LDHA蛋白的表达显著下调(图3.L)。而用糖酵解抑制剂2-DG处理PTC细胞后,FTO敲低引起的细胞增殖和集落形成被抑制(图3.F-G)。体内实验结果也显示,敲低或过表达FTO基因后,异种移植小鼠肿瘤模型中的葡萄糖摄取显著增加或降低(图3.H/M)。然而,过表达FTO-mut后,在体内和体外均未观察到对糖酵解的影响(图3.I-M),表明FTO依赖其去甲基化结构域调节糖酵解。综上所述,这些研究表明FTO通过调节糖酵解来抑制PTC的进展。
04 RNA-seq和MeRIP-seq确定APOE为FTO的靶基因
为了探索FTO在PTC中的下游潜在靶点,作者采用K1细胞进行RNA-seq检测了si-NC组和si-FTO组的表达差异基因(DEGs)。结果显示,FTO基因敲低后,有490个基因表达显著下调,而有675个基因表达显著上调(图4.A)。为了验证基因表达的变化是否与FTO介导的m6A修饰有关,作者采用m6A MeRIP-seq筛选在K1细胞中FTO敲低后显著升高的m6A峰。m6A MeRIP-seq组在si-NC组有2553个独特的m6A峰,在si-FTO组有1989个独特的m6A峰,两组有8496个共有的m6A峰(图4.B)。分析显示,在si-NC和si-FTO组中,m6A峰在终止密码子附近高度富集(图4.C)。对K1细胞中m6A甲基化组的分析显示,最常见的m6 A基序“GGACU”在m6A峰中高度富集(图4.D)。接下来,作者筛选了7个m6A甲基化水平及基因表达水平均上调的基因,进行进一步的功能实验,其中APOE可能是FTO介导的m6 A修饰的关键基因,因为它可以调节PTC的糖酵解代谢(图4.E)。对m6A MeRIP-seq结果进行IGV可视化,显示APOE mRNA在终止密码子附近有一个在FTO敲除后显著升高的m6A峰(图4.F)。然而,APOE在PTC中的表达和生物学功能有待进一步阐明。因此,作者选择APOE作为FTO介导的m6A修饰的靶基因进行后续分析。
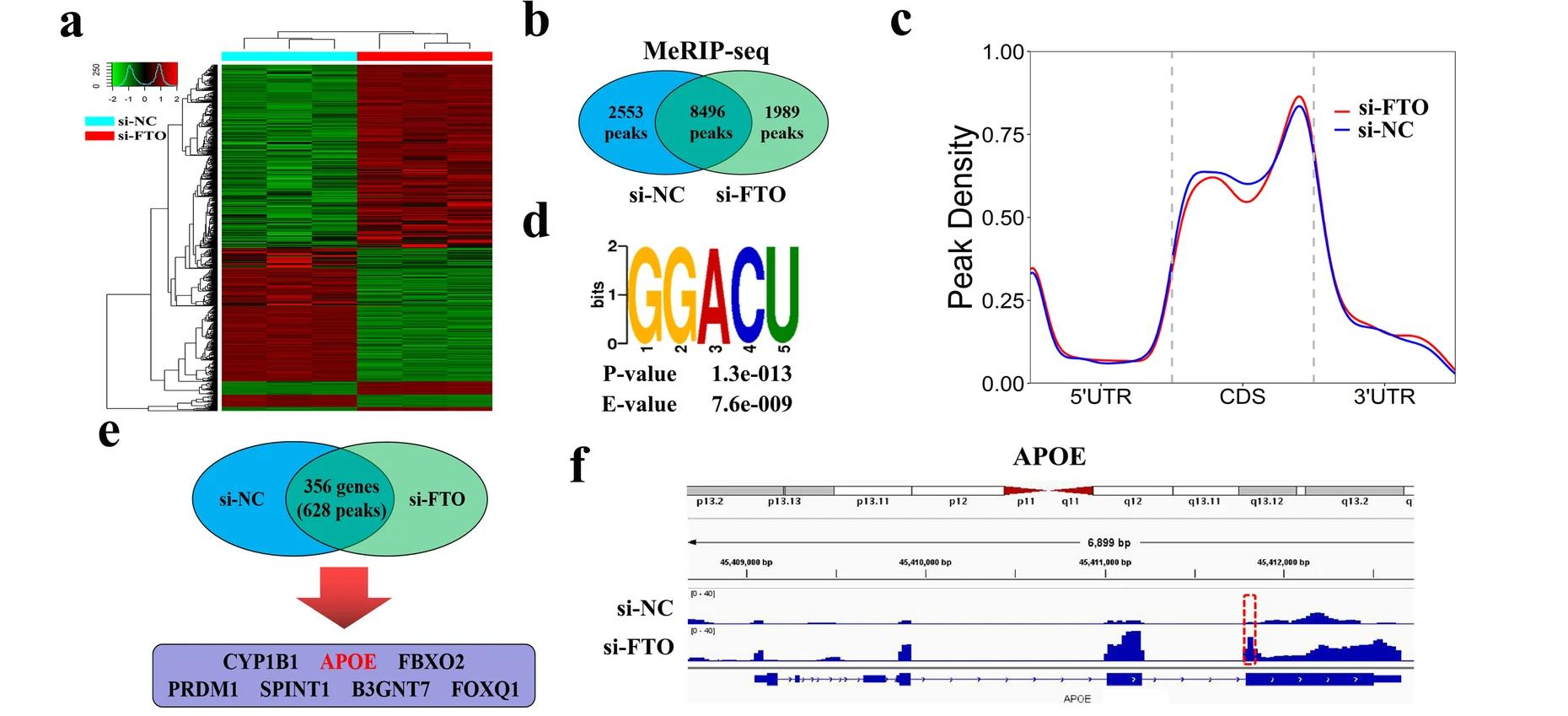
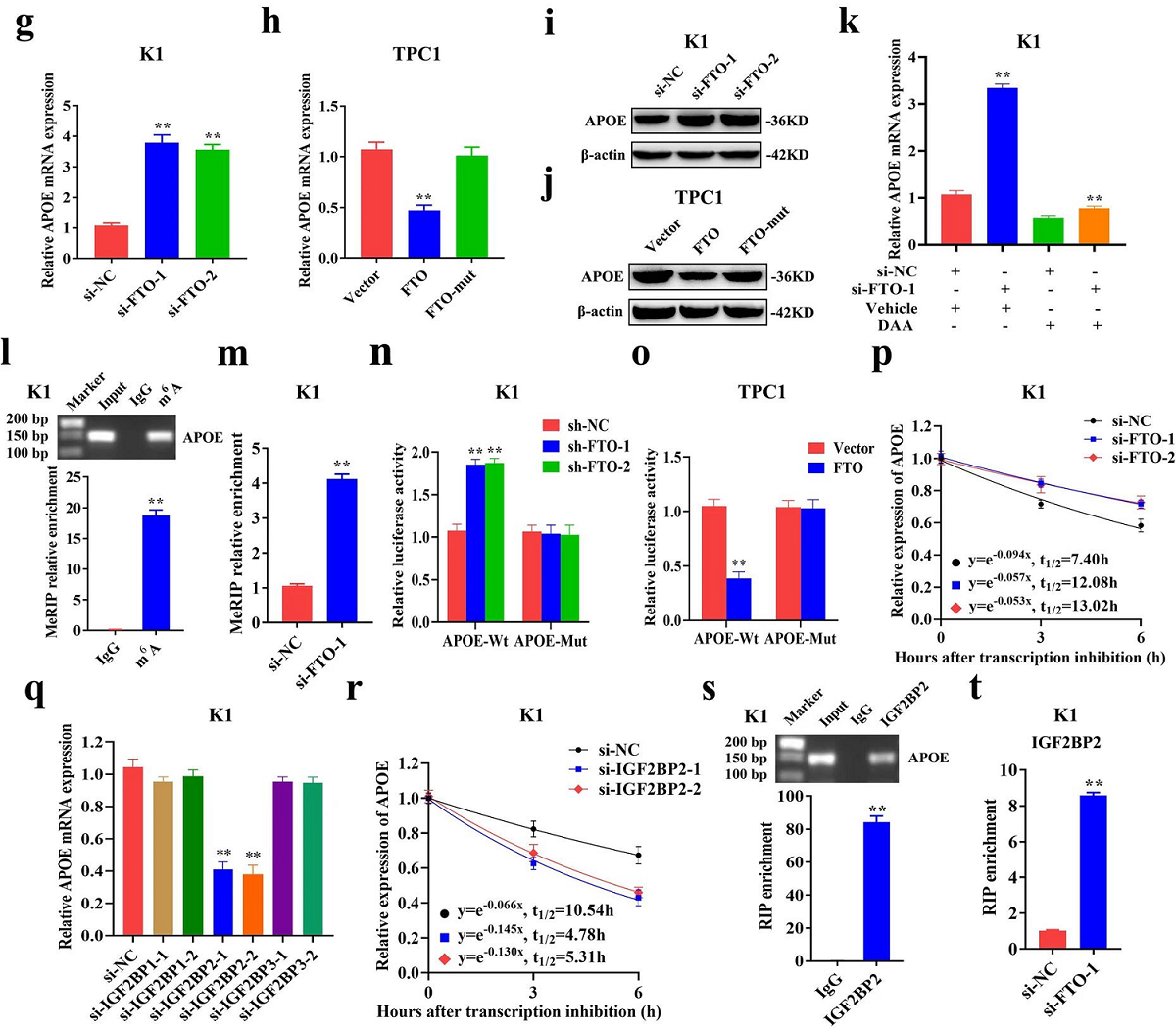
05 FTO通过IGF2BP2介导的m6A修饰调节APOE mRNA的稳定性
与m6A MeRIP-seq分析结果一致,FTO的敲低或过表达上调或下调了APOE的基因及蛋白表达水平(图5.G-J),且过表达FTO-mut后,APOE的表达没有发生变化(图5.H-J)。为了探索FTO对APOE的m6A修饰,作者使用了一种甲基化抑制剂DAA处理,结果显示DAA显著降低了FTO敲低所上调的APOE的表达(图5.K)。接下来,作者采用MeRIP-qPCR方法验证来m6A MeRIP-seq数据,结果显示,在FTO敲低后,APOE mRNA的m6A水平显著升高(图5.I-M)。随后,作者构建了包含野生型或突变型APOE的荧光素酶报告基因,以探索m6A修饰对APOE表达的影响。结果显示,敲低或过表达FTO显著增加或降低了野生型APOE的荧光素酶活性,而对突变型APOE的荧光素酶活性没有明显的影响(图5.N-O)。这些结果表明,FTO在APOE的m6A修饰中起着一定的作用。
此外,APOE的表达随着m6A修饰水平的增加而显著增加,提示其m6A修饰可能增加了APOE mRNA的稳定性。与预期结果一致,RNA稳定性曲线显示,在K1和TPC1细胞中,FTO敲低后,APOE mRNA的半衰期显著延长(图5.P)。因此,FTO诱导的APOE表达上调可归因于m6A修饰导致的APOE mRNA稳定性的增加。作为m6A readers,IGF2BP1-3可调节mRNA的稳定性,进一步分析显示,敲低IGF2BP2,而不是IGF2BP1/3,显著下调了K1和TPC1细胞中的APOE mRNA(图5.Q)。此外,在K1和TPC1细胞中,IGF2BP2基因敲低后,APOE mRNA的半衰期显著降低(图5.R)。针对IGF2BP2的RIP-qPCR结果表明,IGF2BP2直接与APOE的m6A位点结合(图5.S),而FTO的下调显著增加了IGF2BP2与APOE mRNA的结合能力(图5.T)。综上所述,这些结果表明,FTO通过IGF2BP2介导的m6A修饰来抑制APOE mRNA的稳定性和表达。
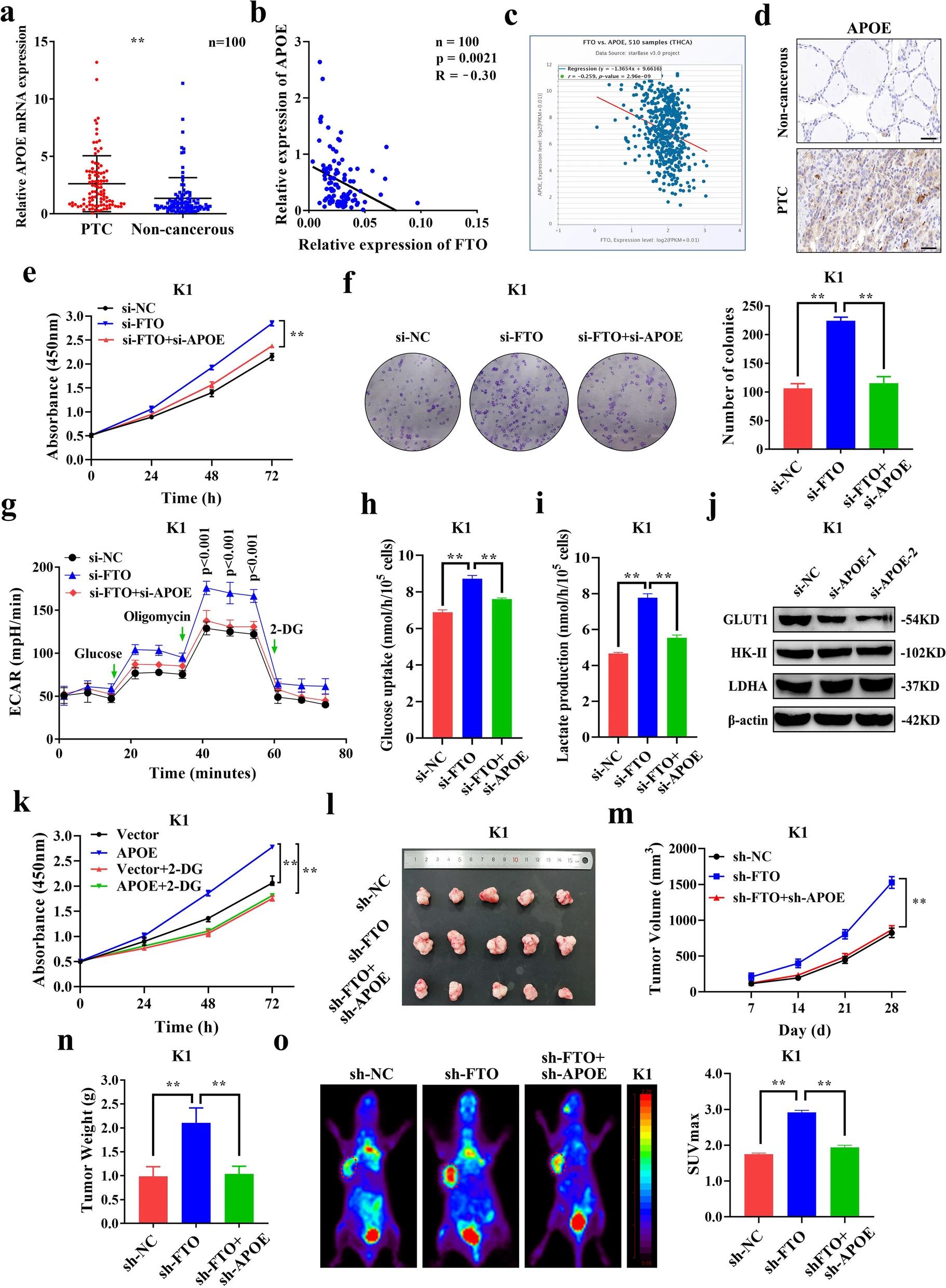
06 APOE通过调节糖酵解来调节PTC的增殖
虽然FTO通过调节糖酵解在PTC生长中发挥重要作用,但尚不清楚该作用是否归因于其下游靶基因APOE。作者通过qRT-PCR检测发现PTC组织中APOE的mRNA表达相对于成对非癌组织显著上调(图6.A),且与FTO的表达水平呈显著负相关(图6.B)。与此结果一致,FTO和APOE在TCGA数据库中的表达也呈明显的负相关(R=-0.259,p=2.96e-09)(图6.C)。此外,PTC组织中APOE蛋白的表达明显高于邻近非癌组织(图6.D)。为了探究APOE在PTC中的作用,作者发现敲低APOE显著降低了si-FTO诱导的高细胞增殖水平(图6.E-F),高ECAR水平(图6.G)以及葡萄糖摄取和乳酸生成的增加(图6.H-I),这表明APOE可以逆转FTO引起的糖酵解速率的增加。对关键糖酵解蛋白表达分析显示,APOE敲低后,只有GLUT1蛋白的表达显著下调,而HK-II和LDHA的表达水平未被影响(图6.J),表明FTO和APOE主要通过调节葡萄糖转运来影响糖酵解。与FTO相似,2-DG抑制了过表达APOE引起的增殖增加(图6.K),表明APOE通过糖酵解影响细胞增殖。体内分析显示,在由sh-FTO引起的异种移植小鼠模型中,sh-APOE显著降低了肿瘤生长(图6.L-M),肿瘤重量(图6.N)以及葡萄糖摄取(图6.O)。这些结果表明,APOE可以通过糖酵解促进肿瘤生长,并在PTC中受到FTO介导的m6A修饰的调控。
07 FTO和APOE可能通过IL6/JAK2/STAT3信号通路调控PTC的糖酵解
为了探索FTO/APOE轴下游的相关信号通路,作者采用基因集合富集分析(GSEA)来鉴定PTC中FTO和APOE的富集特征,发现,FTO/APOE下游的共同信号通路只有IL-6/JAK/STAT3信号通路。基于RNA-seq数据的GSEA结果显示,与si-NC组相比,si-FTO组中IL-6/JAK/STAT3信号通路高度富集(图7.A)。此外,基于TCGA数据库的GSEA结果显示,APOE高表达组与低表达组相比,IIL-6/JAK/STAT3信号通路高度富集(图7.B)。这些GSEA研究结果表明,FTO和APOE可能通过调节IL6/JAK/STAT3信号通路来影响PTC的糖酵解。随后,作者通过WB实验发现FTO敲低后,该通路中磷酸化的JAK2(pJAK2)和STAT3(pSTAT3)的蛋白表达水平显著升高,而过表达FTO则相反(图7.C-D)。此外,在APOE敲低后,这两种磷酸化蛋白的蛋白表达水平显著降低,而过表达APOE的作用则相反(图7.E-F),且APOE敲低显著消除了si-FTO引起的pJAK2、pSTAT3和GLUT1蛋白表达水平的升高(图7.G)。综上所述,APOE在PTC中,通过FTO修饰m6A后调节IL6/JAK2/STAT3信号通路,对糖酵解发挥作用。
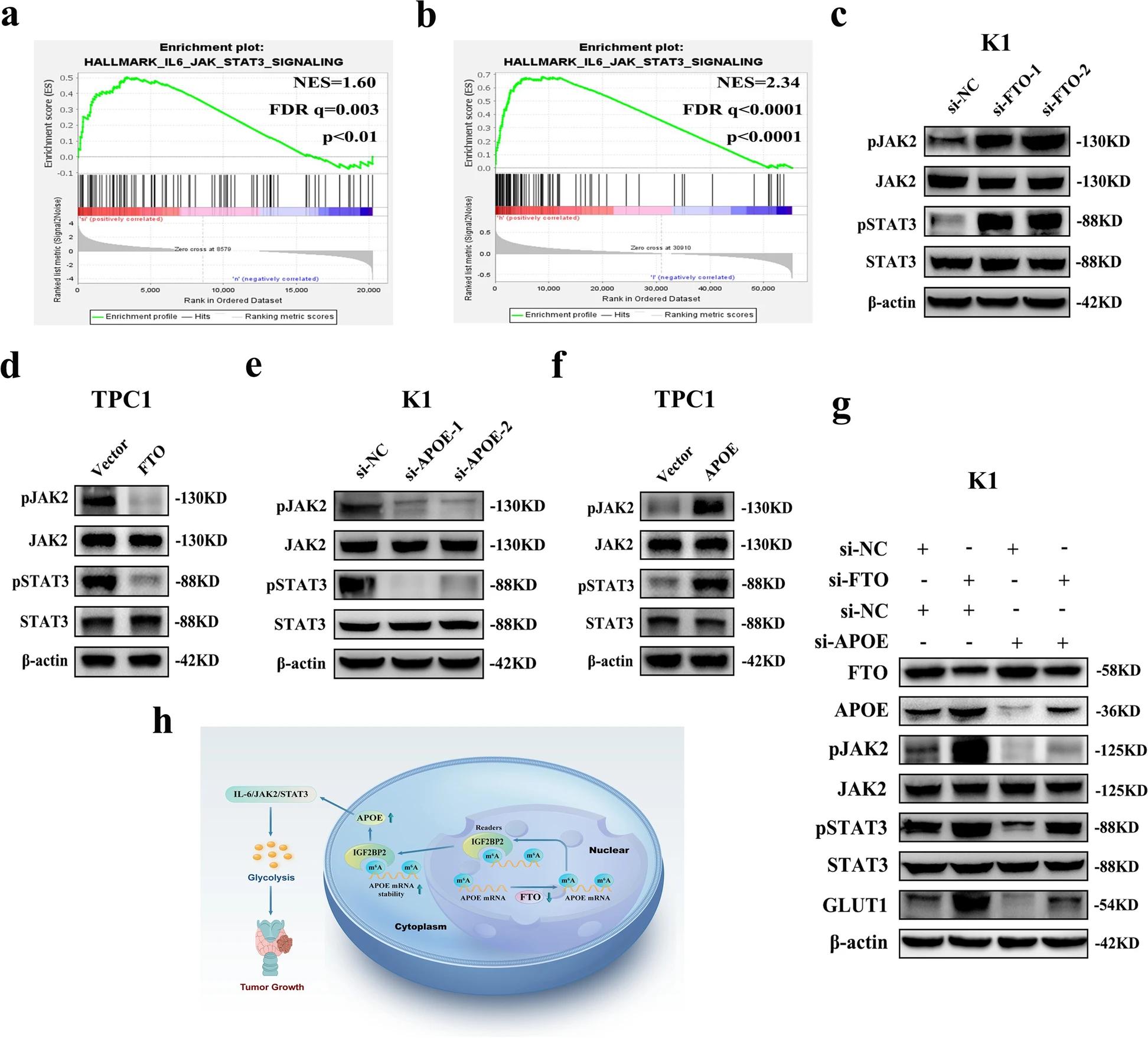
本文通过一系列体内外功能实验发现去甲基化酶FTO抑制了PTC的糖酵解和生长,并通过RNA-seq、m6A MeRIP-seq联合分析鉴定得到了FTO下游靶基因APOE。作者通过对APOE的进一步机制及功能研究,发现FTO通过IGF2BP2介导的m6A修饰抑制APOE的表达,且可能通过调节IL-6/JAK2/STAT3信号通路来抑制PTC的糖酵解代谢,从而抑制肿瘤生长。该文章为从甲基化修饰酶出发的m6A机制研究提供了一个极佳的参考范本。文中机制研究涉及到的整体甲基化水平检测,RNA修饰相关酶筛选,RNA-seq&m6A MeRIP-seq,以及后续MeRIP-qPCR验证,RIP-qPCR机制互作研究等,云序生物均可为您提供一站式服务。
01 m6A RNA修饰测序
对m6A RNA甲基化,目前最流行的检测手段为m6A-MeRIP-Seq技术,适用于m6A RNA甲基化谱研究,快速筛选m6A RNA甲基化靶基因。云序可提供mRNA和多种非编码RNA的m6A测序:
m6A 全转录组测序(涵盖mRNA,LncRNA,circRNA)
m6A LncRNA测序(涵盖LncRNA和mRNA)
m6A Pri-miRNA测序(涵盖Pri-miRNA和mRNA)
m6A mRNA测序
m6A miRNA测序
02 检测整体m6A RNA修饰水平
精准高效,可以实现一次检测,9类修饰水平检测,一步到位。
快速检测m6A整体甲基化水平
03 m6A RNA修饰上游酶的筛选
寻找上游直接调控m6A RNA甲基化的甲基转移酶。
04 m6A RNA修饰靶基因验证
MeRIP-qPCR/GenSeq® MeRIP试剂盒
云序提供各类不同修饰的meRIP-qPCR服务以及销售GenSeq® MeRIP试剂盒,可针对mRNA,lncRNA,环状RNA等不同类型的RNA分子进行检测,低通量验证RNA修饰靶基因表达水平。
05 机制互作研究
5.1 RIP-seq/qPCR/GenSeq® RIP试剂盒
筛选或验证RNA修饰直接靶点,研究RNA修饰靶基因的调控机制。
筛选或验证目标RNA互
